

期刊:CANCER RES
影响因子:11.2
技术服务:10x Genomics Spatial transcriptomics
导语
晚期高级别浆液性卵巢癌(HGSC)是一种侵袭性疾病,占所有卵巢癌死亡人数的 70%。然而,被诊断为晚期 HGSC 的患者仅有 15% 的存活时间超过 10 年。在存活时间超过 10 年的卵巢癌患者的肿瘤中分析空间分辨的基因表达模式,可以识别新的预测性生物标志物和治疗靶点,从而更好地管理患者。
技术方法
10x Genomics Spatial transcriptomics
研究路线图
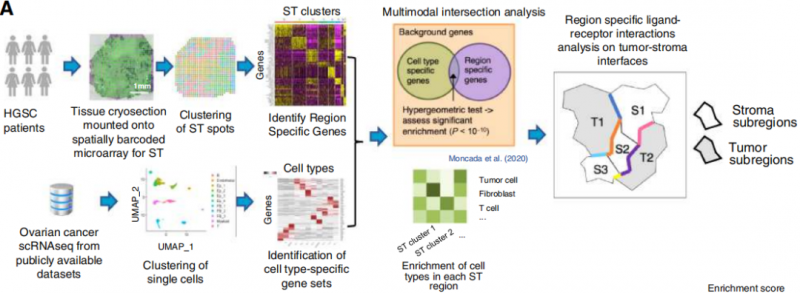
研究结果
1. HGSC 肿瘤的空间转录组测序谱
对 4 个治疗后的晚期 HGSC 样本(2 个 LTS(long-term survivors)和 2 个 STS(short-term survivors)进行了空间转录组学分析(10x)。空间转录组学进行聚类分群。分析了公开的 scRNA-seq 数据,用于定义主要细胞类型。scRNAseq 和空间转录组学通过多模态交叉分析(MIA) 进行联合分析,计算细胞类型特异性和区域特异性基因集之间的重叠部分。进行超几何检验用于评估显著富集,阈值为 P <10-10。从 MIA 图中,观察到一些肿瘤簇中免疫细胞的浸润(例如,B 细胞在 LTS#1_c5 和 LTS#1_c2 簇中富集)。分析了第二个公开的 scRNA-seq 数据集,用于定义免疫细胞类型,然后进行了如上所述的 MIA 分析。与 LTS 样本相比,STS 样本具有丰富的肿瘤浸润性免疫细胞。GO 分析显示了肿瘤簇和间质簇之间的差异
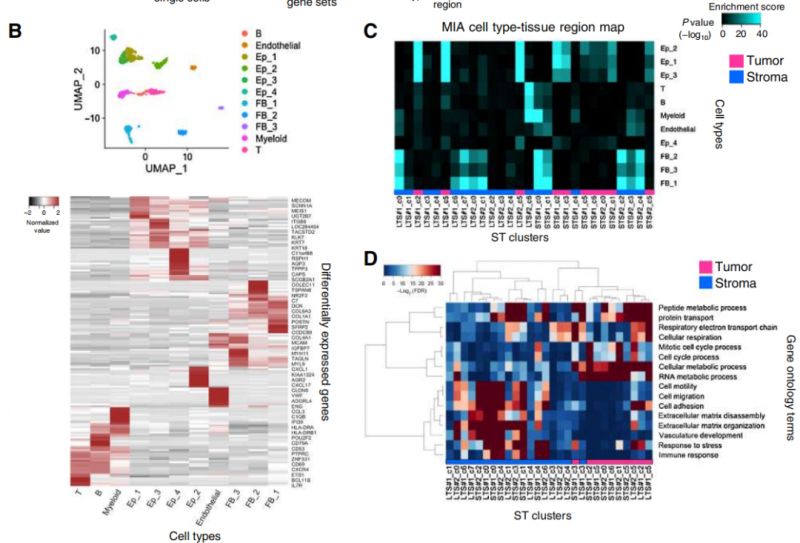
2. 肿瘤和间质细胞簇的鉴定和定位
通过空间转录组学数据的富集分析来验证肿瘤 / 间质分类的准确性,对每个样本绘制了主要肿瘤和间质标记物的归一化表达,并将其覆盖在苏木精和伊红图像上。证实了肿瘤标志物 WFDC2、MUC16 和 CLDN4 的表达定位于肿瘤区域,而 COL1A1、VIM 和 FN1 的表达被限制在间质区域。对空间转录组 spot 进行聚类后,发现 4 个肿瘤样本之间存在高度的异质性,并对肿瘤和间质聚类进行了注释。STS#1_c2 和 STS#2_c1 肿瘤簇 CDK1 的表达增加,这是哺乳动物细胞中细胞周期进展最重要的调控因子之一。肿瘤簇 STS#1_c2 和 STS#2_c0 高表达 LGR5,通过激活 Wnt/b-catenin 信号,促进癌细胞迁移、肿瘤形成和上皮 - 间充质转化。相比之下,在 LTS#1 和 LTS#2 患者的任何肿瘤簇中均未检测到 CDK1 和 LGR5。此外,所有四个样本中的大多数肿瘤簇都表达了 WFDC2,与正常卵巢组织相比,该基因在卵巢癌中通常过表达。
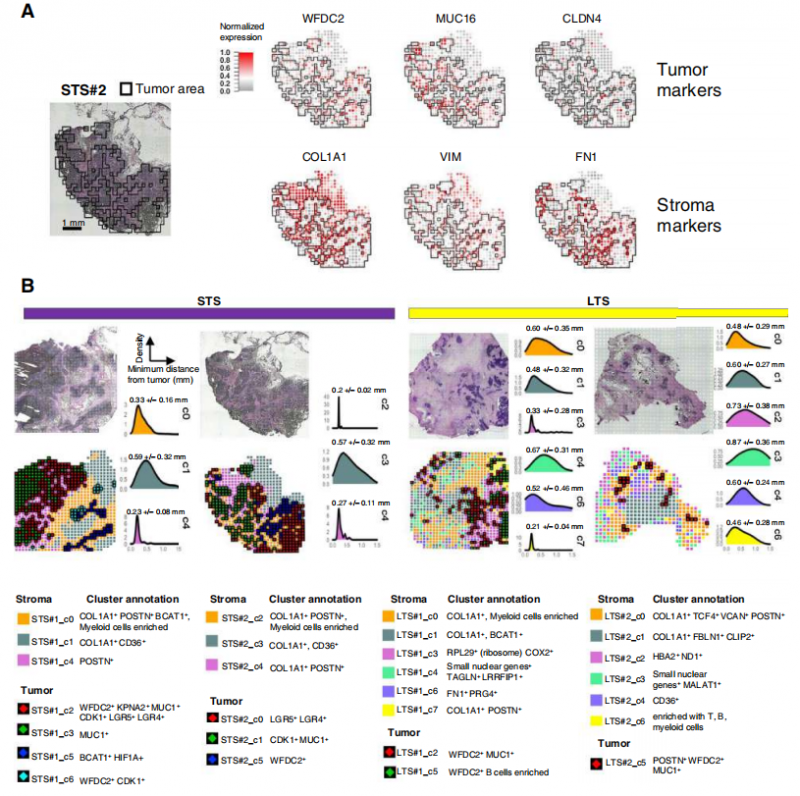
3. 基质细胞的异质性
对肿瘤细胞和间质细胞的定位,分析表明 HGSCs 间质内和间质间存在异质性。来自 STS#1 和 STS#2 患者的肿瘤与来自 LTS#1 和 LTS#2 患者的肿瘤不同。生存分析显示,患者 LTS#1 和 LTS#2 是 OS 持续时间超过 120 个月的 LTSs,而患者 STS#1 和 STS#2 是 OS 持续时间小于 24 个月的 STSs。
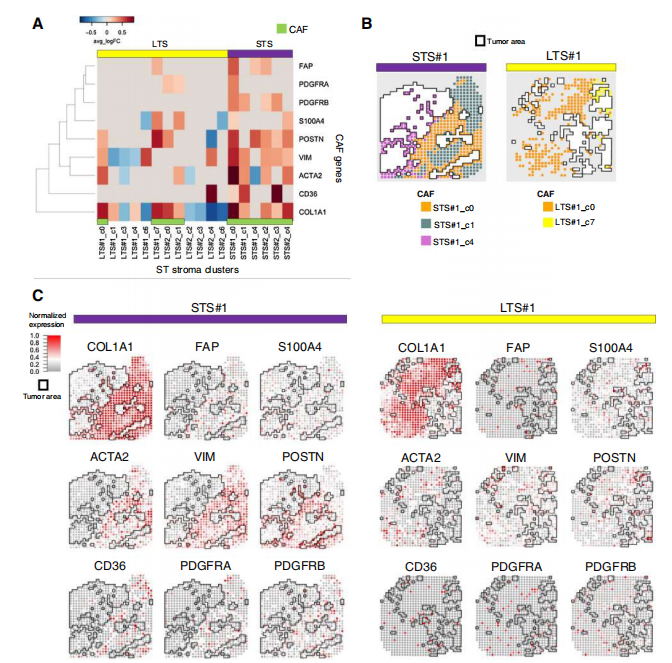
为了进一步分析基质异质性以及传统 CAF 标记物与基质簇之间的关系,在确定的基质簇中评估了传统 CAF 标记物的表达,包括 aSMA(ACTA2)、S100A4、VIM、FAP、PDGFRa(PDGFRA)和 PDGFRb(PDGFRB)。在两个 LTS 样本中,6 个基质簇中只有 2 个(LTS#1 和 LTS#2)表达了传统的 CAF 标记物,而 STS 样本中的所有基质簇(STS#1 和 STS#2)都表达了 CAF 的基因。说明间质簇在肿瘤组织中富含 CAFs,而在 LTS 肿瘤中,只有一小部分的间质簇富含 CAFs。在两个 STS 样本中,CAF 簇表达了一组不同的 CAF 标记,并且大多数表达了 8 个 CAF 标记中的大多数。相比之下,在两个 LTS 样本中,所有有 CAF 标记表达的基质簇都表达了 8 个 CAF 标记中的少数。这些发现表明,HGSC 的肿瘤内和肿瘤间 CAF 存在异质性,而具有表达多个 CAF 标记物的丰富 CAF 簇的肿瘤可能与短期生存相关。接下来,绘制了每个 CAF 标记物的平均表达量作为到肿瘤距离的函数,分析了不同 CAF 簇的空间分布和用于注释相对于肿瘤簇的关键分子。肿瘤簇附近的 CAF 簇(如 STS#1_c0、STS#1_c4 和 LTS#1_c7)表达了高水平的 POSTN。位于远离肿瘤簇的 CAF 簇(如 STS#1_c1 和 LTS#2_c4)表达了高水平的 CD36。这些发现表明,卵巢 TME 中空间解析的 CAF 亚群可能在赋予肿瘤细胞的恶性表型中发挥不同的作用。
4. 细胞通讯分析,信号网络相互分析
为了表征 CAFs 和肿瘤细胞之间的区域特异性配体 - 受体相互作用,对于每个样本中的每个肿瘤和 CAF 簇,并进行配体 - 受体分析。在 STS 和 LTS 样本的间质 - 肿瘤界面上,共分别鉴定出 84 对和 50 对不同的配体 - 受体对。在 STS#1_c0- STS#1_c2 和 STS#2_c4- STS#2_c5 发现了 APOE(配体)和 LRP5(受体),在 STS#1_c0- STS#1_c6 发现了 THBS2(配体)和 CD47(受体)。分析了相邻间质与肿瘤亚区域之间的区域特异性配体 - 受体相互作用网络。在样本 STS#1 中,每个间质和肿瘤簇之间识别了 60 对不同的配体 - 受体对。每个间质配体(APOE、THBS2、FN1)都可能与多个肿瘤受体结合。肿瘤受体(ITGB1 和 ITGB8)也从多个基质配体接收信号。为了寻找与癌症患者预后和转移过程相关的配体 - 受体对,确定了 9 对与 STS 样本相关的配体 - 受体对(APOE-LRP5、THBS2-CD47、PLAU-PLAUR、WNT10AFZD5/FZD7、TGFB1-ENG/ACVRL1、IGF1-IGF1R、SEMA3C-NRP2)和 1 对与 LTS 样本相关的配体 - 受体对 (A2M-LRP1)。
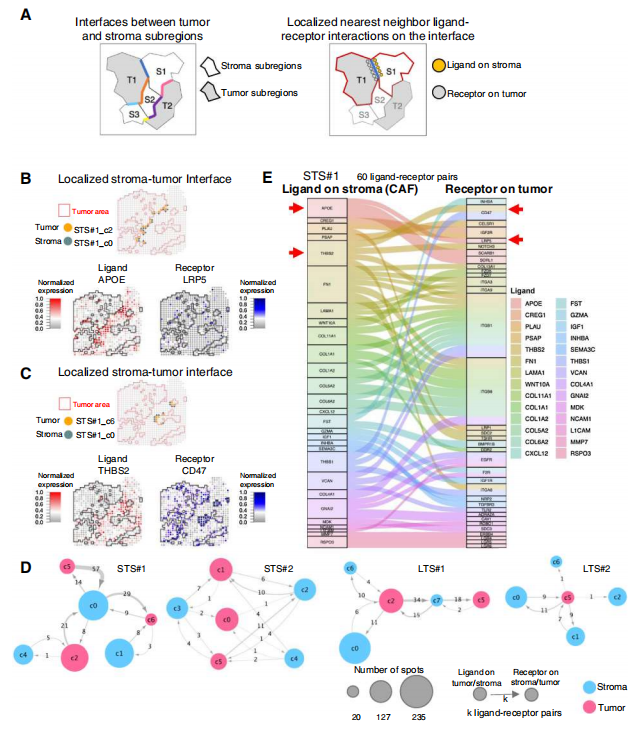
总之,空间转录组学分析显示,卵巢 TME 中存在高水平的肿瘤间和肿瘤内 CAF 异质性,以及新的空间分辨的 CAF- 肿瘤串扰信号网络,这与晚期 HGSC 患者的长期生存相关。进一步阐明这些空间分辨的生物标志物与长期生存率之间的关系,有助于我们理解卵巢癌的发病机制,从而提高晚期 HGSC 患者的生存率。
参考文献:
Ferri-Borgogno Sammy,Zhu Ying,Sheng Jianting et al. Spatial Transcriptomics Depict Ligand-Receptor Cross-talk Heterogeneity at the Tumor-Stroma Interface in Long-Term Ovarian Cancer Survivors.[J] .Cancer Res, 2023, 83: 1503-1516.

