技术背景
2018 年以来,越来越多的药物研发机构开始注意到单细胞测序技术在药物研发上的优势。首先是通过分析不同病人样本的单细胞图谱来挖掘潜在的靶点(细胞、通路和分子),主要是在 RNA 和蛋白水平上筛选及验证细胞特异性表达的药物靶标。其次,探究病人组织微环境中细胞类型与分子特征的相关性,如靶标与特定的免疫细胞或基质细胞、信号通路、空间位置、受体配体等的相关性,从而更好地确定靶标的作用方式及细胞 - 细胞相互作用。一旦确定了靶点,需将候选模型与病人的单细胞表达谱进行比较,以确定匹配的模型。并且单细胞测序还能用于进一步探究细胞构成及基因表达在用药前后的变化,及治疗有效 / 无效之间的差异,以评估治疗过程及新药物的有效性;此外,对不同药物及其组合进行单细胞测序比较,还可筛选治疗组合。

为什么 更多科研工作者 选择 伯豪生物单细胞测序技术服务?
2020 年,行业首份《单细胞测序行研报告》系伯豪生物编写、联合出版;
2021 年,Bio-protocol 单细胞测序技术实验方法复现集系伯豪生物联合出版;
●大样本量验证:30 万样本 / 年,伯豪专业技术服务团队实验经验丰富;
●严格质量标准:QA 系统为您实验全程护航,实验严格按照 156 个 SOP 文件进行;
●实验记录完备: 严格的流水线作业项目管理流程,保证所有实验记录可供回溯;
●多重实验质控: 实验室 QC、数据分析 QC、项目管理 QC,3 重 QC 有效减少低质量数据。
伯豪生物 单细胞测序技术 能够应用到哪些领域?
单细胞测序技术以其高通量、高分辨率的特点,使人们开始意识到它在药物研发中的巨大潜力,包括在单细胞水平上进行高通量地药物靶点筛选、药代动力学分析、药效评价等,极大地缩减药物发现周期、节约新药研发成本。单细胞测序技术为新药研发注入新的希望,有助于药物研发机构优化新药研发管线。
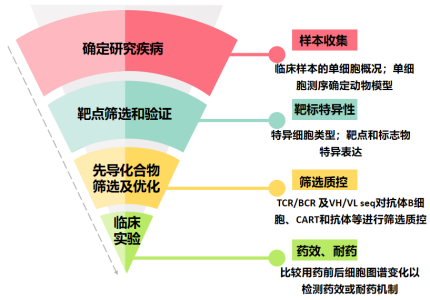
▲驱动药物开发的单细胞测序技术

案例 1:
2018 高级别浆液性卵巢癌(high-grade serous ovarian carcinoma)是致死率高的妇科恶性肿瘤。目前对浆液性卵巢癌的治疗方案创新极其受限,主要原因之一就是缺乏一个稳定的肿瘤分子分型体系。2020 年 2 月 10 日,牛津大学 Weatherall 分子医学研究所 Ahmed A. Ahmed 实验室和曼彻斯特大学 Christopher Yau 研究组在 Cancer Cell(IF=26.6)杂志发表相关研究论文 [1]。这项研究通过深度单细胞 RNA 测序技术 Smart-Seq2 刻画了人输卵管上皮组织,共测序了约 6000 个主要来自非卵巢癌病人的正常输卵管上皮细胞(非癌细胞),发现并验证了输卵管上皮内的 6 种新细胞亚型,包括 4 种分泌细胞亚型,1 种分泌 - 纤毛中间态细胞亚型以及 1 种特殊的组织原位 T 细胞。非癌症病人和癌症病人的输卵管上皮细胞都有 Cellcycle, EMT, Differentiated 和 KRT17 cluster 四个亚群的细胞。通过分析发现 TCGA 和 AOCS 数据库很大比例的样本都可以通过 52 个 marker 基因(7 differentiated markers, 10 KRT17 cluster markers, 12 EMT markers, 15 cell-cycle markers, 和 8 ciliated markers)形成的 panel 进行主要分群。研究者们进一步发现“分解”分析(deconvolution)中的 EMT(epithelial-mesenchymal transition,上皮 - 间质转化)细胞状态的比例和病人预后显著负相关,12 个 EMT marker 显示表达比例越高的病人其生存期越低,且这一相关性在九个独立数据库中都可被重复出来。为了进一步证明 EMT 及其他四种细胞状态的信号可来自于癌细胞,研究者们利用激光捕获显微切割技术(LCM)获取了纯度更高的肿瘤样本,并进行了转录组测序,对 LCM 样本数据分析重现了在 TCGA 等公共数据库里的发现,并通过免疫荧光染色在组织切片和卵巢癌细胞系 KURAMOCHI 中进行了验证。总之,这项研究利用单细胞测序定义了一个肿瘤分子分型体系,对卵巢癌的预后分析带来重要影响。


案例 2:
CD73 是一个抗肿瘤的热门靶点。免疫检查点疗法(ICT),例如抗 CTLA- 4 和抗 PD-1/PD-L1 已经极大地变革了人们对多种肿瘤的治疗方式。但是临床上只对部分特定肿瘤类型的患者提供持久的抗肿瘤反应。肿瘤特异性免疫检查点靶向的机制基础尚不清楚。为了深入了解肿瘤特异性免疫调节靶点,来自美国德克萨斯大学 MD 安德森癌症中心 Padmanee Sharma 研究团队通过分析多种病人来源的 5 种不同类型肿瘤中浸润的免疫细胞分型,发现了神经胶质瘤中特异性存在 CD73(hi) 的巨噬细胞。研究团队对四个 GBM 肿瘤进行了单细胞 RNA 测序 [3],细胞分成了 17 个亚群,包含了 4 个 CD3+ T 细胞和 10 个 CD3−CD68+ 髓系细胞。在 10 个 CD3−CD68+ 髓系细胞中,其中有 4 个是 CD73(hi)。ScRNA-seq 显示 CD73(hi) 髓样细胞富含免疫抑制基因,并且具有与常驻小胶质细胞特征不同的特征。将 CD73 巨噬细胞的基因与癌症基因组图谱(TCGA) 中的胶质母细胞瘤样本进行比较,结果表明 CD73 高表达的巨噬细胞的基因特征与存活率下降相关。研究人员分析了 5 名接受过 PD- 1 抑制剂 Keytruda 治疗和 7 名未接受过 PD- 1 抑制剂治疗的胶质母细胞瘤患者,均发现了表达 CD73 的巨噬细胞簇,说明抗 PD- 1 治疗没有使胶质母细胞瘤的微环境发生明显改变。

▲图 CD73(hi) 巨噬细胞特异性存在于 GBM 中 [2]
为验证 CD73 是否可以在 GBM 治疗中作为一种联合治疗的靶点。研究人员在 WT 和 CD73-/- 小鼠中构建 GL261 GBM 肿瘤模型,CD73 的缺失可以通过调控肿瘤内髓系细胞的亚群改变而提高小鼠生存。同时,CD73 的缺失可以提高 GBM 小鼠模型对抗 PD- 1 和抗 CTLA- 4 联合治疗的响应,提高了 iNOS+ 免疫刺激巨噬细胞和颗粒酶素 B + CD8 T 细胞在瘤内比例。肿瘤微环境中存在多种免疫检查点,本研究通过对多种不同类型肿瘤细胞浸润免疫细胞分析,发现不同免疫检查点的存在是有肿瘤类型特异性的,其中 CD73hi 髓系细胞亚群,特异性出现在 GBM 中,靶向 CD73 分子可提高机体对免疫检查点疗法的响应和疗效。

▲图 在 GBM 小鼠模型中,CD73 的缺失增强了 ICT 的疗效 [2]
引用文献:
[1]. Hu Z, Artibani M, Alsaadi A, et al. The Repertoire of Serous Ovarian Cancer Non-genetic Heterogeneity Revealed by Single-Cell Sequencing of Normal Fallopian Tube Epithelial Cells[J]. Cancer Cell, 2020, 37(2):226-242.
[2]. Goswami S, Walle T, Cornish A E, et al. Immune profiling of human tumors identifies CD73 as a combinatorial target in glioblastoma[J]. Nature Medicine, 2020, 26(1):1-8.
案例 1:抗体药 PD1/PDL1
肿瘤浸润性淋巴细胞(tumor infiltrating lymphocytes, TIL):浸润在肿瘤内的淋巴细胞,以 T 细胞为主,也含有其他免疫细胞。由于里边含有能够识别杀伤肿瘤的 T 细胞(肿瘤反应性 T 细胞,tumor reactive T cells)而备受关注。阻断 T 细胞抑制性检查点受体的免疫疗法已经改变了癌症患者的临床护理。然而 T 细胞对检查点阻断的反应是否依赖于预先存在的肿瘤浸润淋巴细胞的再激活或新 T 细胞的募集尚不清楚。2019 年一项发表于 Nature Medicine 上的研究从 11 位诊断为基底细胞癌患者接受 PD- 1 抑制剂治疗前后的组织标本中获取 T 细胞进行 RNA 单细胞测序和 TCR 测序,以研究 PD- 1 抑制剂是否通过肿瘤浸润 T 细胞的“再激活”或是通过招募新的 T 细胞到达肿瘤区域发挥抗肿瘤效应 [3]。

▲图 11 例患者治疗前后所有肿瘤细胞聚类 [3]
本研究的重点是免疫细胞,尤其是浸润性免疫细胞,以及治疗前后的变化,以了解克隆性 T 细胞对 PD- 1 抗体治疗的反应。因此研究人员把所有的 33106 个肿瘤浸润性 T 细胞做了个更细致的分类,包括表达 CD4 的调节性 T 细胞(Treg)细胞,滤泡辅助性 T(TFH)细胞,T 辅助细胞 17(TH17)细胞;以及表达 CD8 的幼稚细胞,记忆 T 细胞,效应记忆 T 细胞,活化 T 细胞,慢性活化 / 耗竭 T 细胞,中度耗竭 / 活化细胞。进一步分析发现,在 PD- 1 抗体治疗之后,滤泡辅助性 T 细胞,以及活化,耗竭和耗竭 / 活化的 CD8 阳性 T 细胞的频率增加,并且耗竭 T 细胞的克隆水平明显更高。更为让研究人员感到意外的是,对于同一个患者而言,治疗后记忆 T 细胞和效应 T 细胞频繁转换为活化状态,但是治疗前的耗竭 T 细胞却没有变成治疗后的非耗竭表型。这表明,即使在 PD- 1 抗体治疗后,已经耗竭的肿瘤浸润 T 细胞也很难再变成活化状态。此外,研究人员还观察到一个有趣的现象,PD- 1 抗体治疗后才出现的耗竭性 T 细胞表现出了新的 TCR 特异性。为了分析外周血中是否存在新发现的肿瘤浸润性 T 细胞,研究人员给患者的血液样品做了 TCR 测序,发现 35.5% 新肿瘤浸润性 T 细胞可以在 PD- 1 抗体治疗后的外周血中找到,而在治疗前的外周血中只能找到 11.8% 的新肿瘤浸润性 T 细胞,不过治疗前的肿瘤里面却没有新肿瘤浸润性 T 细胞。总的来说,与“冷”肿瘤相比,“热”肿瘤之所以响应 PD- 1 抗体的治疗,可能是由于“热”肿瘤自身的特性,让它能够不断吸引新 T 细胞进入,而不是重新激活已有的肿瘤浸润性 T 细胞。这项研究让我们对免疫检查点抑制剂的作用机制有了新的认知,这对临床治疗和疗效的检测都有一定的价值和意义。

案例 2:细胞治疗
目前,以 CD19 为靶点的 CAR- T 细胞治疗已被证明对复发性、难治性 B 细胞恶性肿瘤如 B 细胞非霍奇金淋巴瘤(NHL)、急性淋巴细胞白血病(ALL)和慢性淋巴细胞白血病(CLL)有显著的治疗作用 [4]。虽然抗 CD19 CAR- T 细胞治疗的早期结果令人欣喜,但是只有不到一半的患者出现了长期的缓解,这意味着大多数患者在接受治疗后要么没有反应要么出现了复发。CAR- T 细胞治疗在不同患者中出现的这些差异的原因到底是什么?2020 年 10 月 5 日在线发表在《Nature Medicine》杂志上的文章探讨了这一问题。对 24 例大 B 细胞淋巴瘤(LBCL) 患者输注自体 CAR- T 细胞后,研究人员对 137,326 个残留的细胞进行了全转录组 scRNA-seq[5]。

▲图 工作流程图 [5]
比较全部恢复(CR) 患者和疾病进行 / 部分恢复(PR/PD) 患者输注产物的细胞类型和功能状态,研究人员发现 PR/PD 患者的输注产物中衰竭的 CD8 和 CD4 T 细胞显著富集,而 CR 患者的输注产物中记忆 CD8 T 细胞显著富集。CR 患者和 PR/PD 患者 CD8 T 细胞的差异表达基因(DEG)鉴定出 4 类细胞群,这些差异表达基因大多与 CD8 T 细胞的激活和衰竭有关,虽然每个细胞群都包含来自所有患者的细胞,但是来自 CR 患者的细胞的相对比例在各个细胞群之间存在显著差异。CD4 T 细胞的 DEG 分析和聚类也表现出类似结果,不同的是增殖相关基因和周期细胞在 CR 患者的高频细胞聚类中表达较高。由此强调了与临床疗效相关的 CAR- T 细胞输注产物细胞的重要转录特征。研究表明输注的 CAR T 细胞产物的细胞和分子多样性是导致经抗 CD19-CAR- T 细胞治疗的 LBCL 患者疗效和毒性差异的主要因素,与输注产物相关的可量化表型可通过在其产生过程中富集所需的、或消除不期望的细胞群体或功能状态而发挥作用。对离散细胞群导致反应不良或高毒性的机制的了解,可能有助于发现治疗干预的途径,从而提高疗效,降低 CAR- T 细胞输注后的毒性。

引用文献
[3]. Li X, Wang M, Xiang R. Clonal replacement of novel T cells: a new phenomenon in the tumor microenvironment following PD-1 blockade[J]. Signal Transduction and Targeted Therapy, 2019, 4:43.
[4] Neelapu Sattva S, Locke Frederick L, Bartlett Nancy L, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma[J]. New England Journal of Medicine, 2017, 377:2531-2544.
[5] Deng Qing, Han Guangchun, Puebla-Osorio Nahum, et al. Characteristics of anti-CD19 CAR T cell infusion products associated with efficacy and toxicity in patients with large B cell lymphomas[J]. Nature Medicine, 2020, 26:1878-1887.
案例 1:病毒疫苗
谢晓亮教授团队利用高通量单细胞 RNA 和 VDJ 测序平台,从 60 位康复期病人身上筛选出 8558 种病毒蛋白结合抗体序列,成功找出 14 株高活性的中和抗体。其中编号为 BD-368- 2 的抗体表现突出,在假病毒实验中的半抑制浓度(IC50)达到 1.2 ng/mL(8pM);在军事医学研究院 P3 实验室进行的真病毒实验中,IC50 达到 15 ng/mL(100pM)。中和抗体体内抗病毒实验进一步证实,利用 hACE2 转基因小鼠模型,感染 SARS-Cov- 2 后给予 BD-368- 2 的治疗使病毒载量下降~2400 倍。而注射 BD-368- 2 后可完全抑制小鼠的病毒感染,达到预防效果。研究团队还利用冷冻电镜得到新冠病毒 Spike 三聚体与中和抗体的高分辨率 3.8Å三维结构密度图。数据显示,抗原上的中和抗体表位与 ACE2 的结合位点重合,从而揭示出中和作用的结构基础。此外,研究人员还证明了可以根据 CDR3H 结构的相似性来选择 SARS-CoV- 2 中和抗体 [7]。

案例 2:病毒疫苗
范德比尔特大学的研究组在 Cell 杂志上发表文章 [8],提出了一种名为 LIBRA-seq 的新的测序技术。作者构建了一个特殊的抗原库,将抗原连接上 DNA 条码和用于流式细胞术分选的荧光标签。接下来,将这个库与富含 B 细胞的样本共孵育。将连有荧光标签的抗原和与之结合的 B 细胞共同分选出来,并进行测序,从而得到 BCR- 抗原序列图谱。利用 LIBRA-seq,研究人员绘制了来自两名 HIV 感染者的数千个 B 细胞的抗原特异性图谱,许多 HIV 和流感特异性抗体的预测特异性得到证实。这项技术可以有效地绘制 BCR 序列及其对应的特异性抗原图谱,在抗体研发和疫苗制备领域具有广泛的应用。

案例 3:个性化肿瘤疫苗
NeoVax 是一种新抗原(Neoantigen)肿瘤疫苗,主要以新抗原为靶点。新抗原通常是肿瘤细胞在发生发展过程中,随机突变产生的新的蛋白质或多肽,一般特异性表达于肿瘤细胞中但不存在与正常组织细胞中。因此,新抗原也成为了肿瘤免疫治疗的理想靶点。早在 2017 年,美国 Dana Farber 癌症研究所应用 NeoVax 治疗恶性黑色素瘤患者,并取得的良好疗效。6 名高复发风险的患者在术后 18 周开始接受 NeoVax 疫苗治疗。在接种后的 2 年多时间内,4 名患者未发现肿瘤复发;另外 2 名恶性黑色素瘤伴肺转移的患者,在接种疫苗后复发,随即开始接受 PD-1 单抗药物的治疗,也获得完全缓解并处于无疾病进展状态 [9]。为了进一步探究 NeoVax 肿瘤疫苗的远期临床疗效及其机制,研究人员对上述 6 名患者及新入组的 2 名患者进行长期随访。在术后 4 年多(55 个月)的中位数随访中,8 名患者全部存活,其中 3 名患者仍未出现复发。复发的 5 名患者中,2 名 IV 期患者接受 pembrolizumab(PD- 1 单抗)治疗后完全缓解(2017 年已报道),1 名患者接受了手术切除且仍未发现疾病证据(NED),2 名患者发展为不可切除的转移性疾病。

对于如此令人兴奋的长期临床疗效,研究人员期望揭示患者体内的变化和机制。研究人员首先试图确定 NeoVax 疫苗诱导的特异性 T、细胞在外周血中的功能状态是如何演变的。他们对新抗原特异性 T 细胞,尤其是 CD4+ T 细胞的特征进行了跟踪和分析。结果发现,NeoVax 疫苗诱导的新抗原特异性 CD4+ T 细胞表现出记忆性和细胞毒性特征。进一步分析了这些患者的 T 细胞,发现这些患者体内不仅产生了靶向的目标新抗原的特异性 T 细胞,而且还扩展到识别其他与黑色素瘤相关的新抗原,起到了更强更持久的抗肿瘤效果 [10]。

引用文献:
[7]. Yunlong Cao, Bin Su, Xianghua Guo, et al. Potent Neutralizing Antibodies against SARS-CoV-2 Identified by High-Throughput Single-Cell Sequencing of Convalescent Patients’B Cells[J]. Cell, 2020, 182(1):73-84.
[8]. Setliff I, Shiakolas A R, Pilewski K A, et al. High-Throughput Mapping of B Cell Receptor Sequences to Antigen Specificity[J]. Cell, 2019, 179(7):1636-1646.
[9]. Ott PA, Hu Z, Keskin DB, et al. An immunogenic personal neoantigen vaccine for patients with melanoma[J]. Nature, 2017, 547(7662):217-221.
[10]. Zhuting Hu, Donna E Leet, Rosa L Allesøe, et al. Personal neoantigen vaccines induce persistent memory T cell responses and epitope spreading in patients with melanoma[J]. Nature Medicine, 2021, 27(3):515-525.
案例 1:病毒疫苗
谢晓亮教授团队利用高通量单细胞 RNA 和 VDJ 测序平台,从 60 位康复期病人身上筛选出 8558 种病毒蛋白结合抗体序列,成功找出 14 株高活性的中和抗体。其中编号为 BD-368- 2 的抗体表现突出,在假病毒实验中的半抑制浓度(IC50)达到 1.2 ng/mL(8pM);在军事医学研究院 P3 实验室进行的真病毒实验中,IC50 达到 15 ng/mL(100pM)。中和抗体体内抗病毒实验进一步证实,利用 hACE2 转基因小鼠模型,感染 SARS-Cov- 2 后给予 BD-368- 2 的治疗使病毒载量下降~2400 倍。而注射 BD-368- 2 后可完全抑制小鼠的病毒感染,达到预防效果。研究团队还利用冷冻电镜得到新冠病毒 Spike 三聚体与中和抗体的高分辨率 3.8Å三维结构密度图。数据显示,抗原上的中和抗体表位与 ACE2 的结合位点重合,从而揭示出中和作用的结构基础。此外,研究人员还证明了可以根据 CDR3H 结构的相似性来选择 SARS-CoV- 2 中和抗体 [7]。

案例 2:病毒疫苗
范德比尔特大学的研究组在 Cell 杂志上发表文章 [8],提出了一种名为 LIBRA-seq 的新的测序技术。作者构建了一个特殊的抗原库,将抗原连接上 DNA 条码和用于流式细胞术分选的荧光标签。接下来,将这个库与富含 B 细胞的样本共孵育。将连有荧光标签的抗原和与之结合的 B 细胞共同分选出来,并进行测序,从而得到 BCR- 抗原序列图谱。利用 LIBRA-seq,研究人员绘制了来自两名 HIV 感染者的数千个 B 细胞的抗原特异性图谱,许多 HIV 和流感特异性抗体的预测特异性得到证实。这项技术可以有效地绘制 BCR 序列及其对应的特异性抗原图谱,在抗体研发和疫苗制备领域具有广泛的应用。

案例 3:个性化肿瘤疫苗
NeoVax 是一种新抗原(Neoantigen)肿瘤疫苗,主要以新抗原为靶点。新抗原通常是肿瘤细胞在发生发展过程中,随机突变产生的新的蛋白质或多肽,一般特异性表达于肿瘤细胞中但不存在与正常组织细胞中。因此,新抗原也成为了肿瘤免疫治疗的理想靶点。早在 2017 年,美国 Dana Farber 癌症研究所应用 NeoVax 治疗恶性黑色素瘤患者,并取得的良好疗效。6 名高复发风险的患者在术后 18 周开始接受 NeoVax 疫苗治疗。在接种后的 2 年多时间内,4 名患者未发现肿瘤复发;另外 2 名恶性黑色素瘤伴肺转移的患者,在接种疫苗后复发,随即开始接受 PD-1 单抗药物的治疗,也获得完全缓解并处于无疾病进展状态 [9]。为了进一步探究 NeoVax 肿瘤疫苗的远期临床疗效及其机制,研究人员对上述 6 名患者及新入组的 2 名患者进行长期随访。在术后 4 年多(55 个月)的中位数随访中,8 名患者全部存活,其中 3 名患者仍未出现复发。复发的 5 名患者中,2 名 IV 期患者接受 pembrolizumab(PD- 1 单抗)治疗后完全缓解(2017 年已报道),1 名患者接受了手术切除且仍未发现疾病证据(NED),2 名患者发展为不可切除的转移性疾病。

对于如此令人兴奋的长期临床疗效,研究人员期望揭示患者体内的变化和机制。研究人员首先试图确定 NeoVax 疫苗诱导的特异性 T、细胞在外周血中的功能状态是如何演变的。他们对新抗原特异性 T 细胞,尤其是 CD4+ T 细胞的特征进行了跟踪和分析。结果发现,NeoVax 疫苗诱导的新抗原特异性 CD4+ T 细胞表现出记忆性和细胞毒性特征。进一步分析了这些患者的 T 细胞,发现这些患者体内不仅产生了靶向的目标新抗原的特异性 T 细胞,而且还扩展到识别其他与黑色素瘤相关的新抗原,起到了更强更持久的抗肿瘤效果 [10]。

引用文献:
[7]. Yunlong Cao, Bin Su, Xianghua Guo, et al. Potent Neutralizing Antibodies against SARS-CoV-2 Identified by High-Throughput Single-Cell Sequencing of Convalescent Patients’B Cells[J]. Cell, 2020, 182(1):73-84.
[8]. Setliff I, Shiakolas A R, Pilewski K A, et al. High-Throughput Mapping of B Cell Receptor Sequences to Antigen Specificity[J]. Cell, 2019, 179(7):1636-1646.
[9]. Ott PA, Hu Z, Keskin DB, et al. An immunogenic personal neoantigen vaccine for patients with melanoma[J]. Nature, 2017, 547(7662):217-221.
[10]. Zhuting Hu, Donna E Leet, Rosa L Allesøe, et al. Personal neoantigen vaccines induce persistent memory T cell responses and epitope spreading in patients with melanoma[J]. Nature Medicine, 2021, 27(3):515-525.

