标题:Personal Neoantigen Vaccines Induce Persistent Memory T Cell Responses and Epitope Spreading in Patients with Melanoma
期刊:Nat Med
影响因子:53.44
导读
借助单细胞测序技术我们可以对一些肿瘤治疗方法的疗效进行评估,例如个人新抗原疫苗被认为是诱导、放大和多样化抗肿瘤 T 细胞反应的有效方法。8 位曾接受过手术的黑色素瘤治疗的患者疾病复发,对他们应用疫苗治疗并评估其临床疗效与引起的循环免疫反应。这几位患者接受 Neo Vax 的治疗时长中位数为 4 年,这是一种长肽链疫苗,平均为每个病人靶向 20 个针对其自身肿瘤的新抗原。所有患者均存活,其中 6 例无活跃疾病症状。实验人员观察到疫苗接种后新抗原特异性 T 细胞反应的长期持久性,体外检测能够找到记忆表型的新抗原特异性 T 细胞。随着时间的推移,新抗原特异性 T 细胞克隆多样化,随之出现多种 T 细胞受体克隆型,显示出不同的功能亲和性。此外,他们检测到疫苗接种和抗原表位扩散后新抗原特异性 T 细胞克隆肿瘤浸润的证据,提示靶向疫苗诱导肿瘤杀伤。因此,个人新抗原肽疫苗诱导的 T 细胞应答持续多年并且能拓宽黑色素瘤患者的肿瘤特异性细胞毒性范围。
科学问题
个性化定制的疫苗在持续数年的肿瘤治疗中效果如何?
实验设计
8 位高风险黑色素瘤复发患者在整个疗程中取自不同时间节点的外周血细胞。
技术平台
10X genomics
1、疫苗诱导的新抗原特异性 CD4+ T 细胞表现出记忆和细胞毒性特征
为验证疫苗的疗效机制,实验人员首先着手确定在注射后患者体内疫苗诱导的新抗原特异性 T 细胞演化流程。为此他们对每位患者免疫新抗原的 T 细胞转录特征进行评估,聚焦于新抗原免疫的 CD4+ T 细胞的分离与辨认。被成功分离且在一系列时间节点上数据可用的样本共有 4 个,实验证明在这些 PBMC 样品中 CD4+ T 细胞能够在体外被检测到(从第三周开始接种疫苗,持续整个疗程)(图 1a,b)。对这 4 名病人中的 3 位进行单细胞测序,在合并所有的细胞并聚类后,共定义出 4 个细胞类群(图 1d)。对每个聚类的显著基因进行评估,发现每个不同的 T 细胞状态都由特定的基因标记辨别(图 1d,e)。为了确定疫苗接种的特定阶段是否与不同的转录状态相关,实验人员根据转录识别簇评估每个时间点的组成(图 1d,f)。在接种前样本中分离出来的 CD4+ T 细胞主要表现为“幼稚样”T 细胞表型(cluster 0)。在开始治疗与加强针注射后(8-20 周)分离出来的 T 细胞主要存在于 cluster1,2 中,揭示了在注射治疗过程中 T 细胞有关细胞毒性和淋巴细胞凋亡样(AICD)状态的转变(图 1g)。在经历一次加强针注射的 4 周后大多数被分选出的 T 细胞表现出记忆样表型。综上,实验结果阐述了在接种新抗原特异性疫苗后 T 细胞从幼稚到效应,凋亡,到记忆分化状态的明显转变。
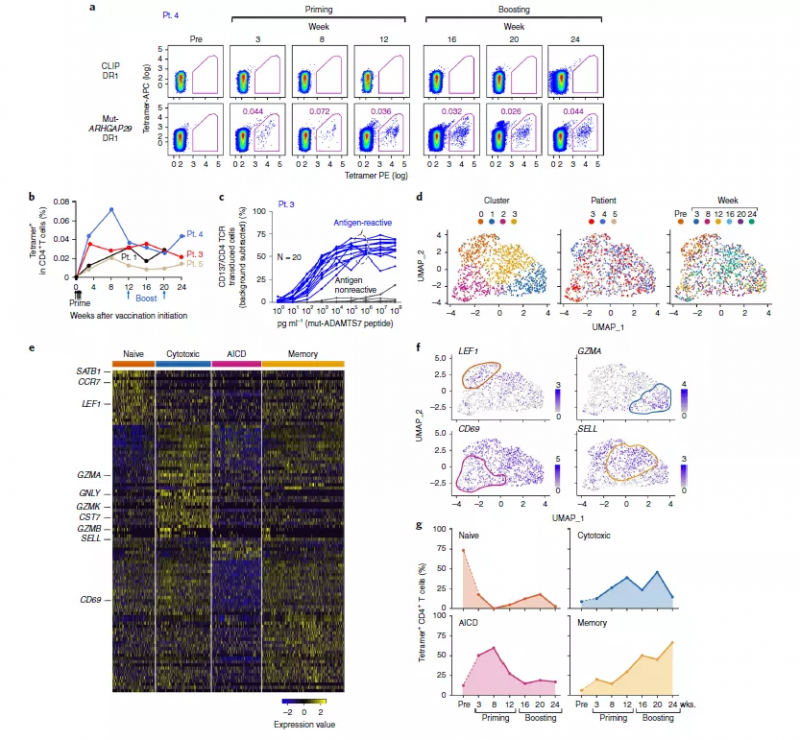
图 1 新抗原特异性 T 细胞在疫苗接疗程中的转录谱
2、在接种疫苗和抗 PD- 1 治疗后,新抗原特异性 TCR 克隆型多样化
为确定在整个疫苗疗程中新抗原特异性 T 细胞的克隆组成转变,研究人员也对这 3 位病人的 TCR 图谱进行了评估。在接受疫苗注射(3,8,12 周)后和加强针注射(16,20,24 周)后能够观察到新克隆型的多种 T 细胞迅速出现(图 2)。他们也评估了 2 和 6 号病人在注射疫苗并进行派姆单抗治疗后的新抗原特异性 T 细胞图谱多样性。对于这两名患者,经历疫苗注射和派姆单抗治疗后在第 16 周经过一轮体外刺激,可以检测到靶向新抗原的 CD4+ T 细胞群(图 3a)。2 号病人的 TCR 克隆型分析显示,在 16 周检测到的 99 个(25%)mut-adm2 特异性 TCR 克隆型中,25 个(25%) 在派姆单抗治疗启动后大约一年后的 89 周仍然存在;值得注意的是,15 个克隆型中有 13 个(87%) 被证实为抗原反应型(图 3b)。在第 16 周出现的 10 个主要克隆型中,有 5 个仍然存在于派姆单抗治疗一年后观察到的 10 个主要克隆型中,在派姆单抗启动一年后 10 个主要的克隆型中有 9 个在第 16 周中就已经存在(图 3C)。在第 16 周时,10 个主要的克隆型中有 9 个仍然在派姆单抗启动一年后观察到的 10 个主要克隆型中,所有出现在派姆单抗处理一年后的 10 个主要的克隆在第 16 周就已经存在(图 3C)。总之,这些种群动态表明,在抗 PD- 1 治疗后,TCR 克隆型会呈现出大量维持以及新克隆型的出现会使 TCR 库发生转变。
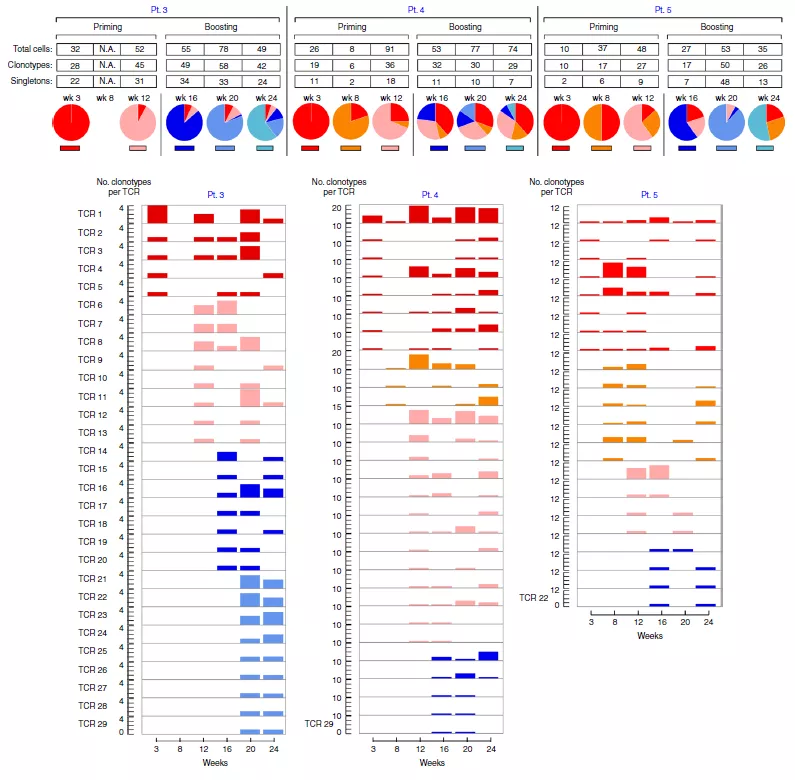
图 2 新抗原特异性 T 细胞的 TCR 图谱动力学
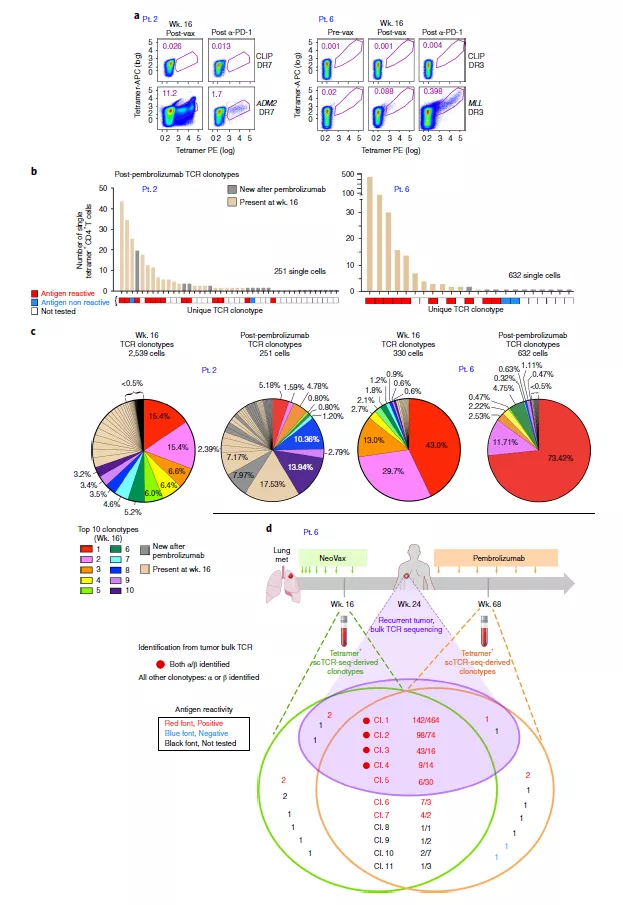
图 3 在疫苗注射和 PD- 1 抑制后新型抗原特异性 TCR 动力学
3、个人新抗原疫苗诱导产生持续数年的记忆 T 细胞反应和 TCR 克隆型
为了评估疫苗诱导的新抗原特异性 T 细胞的长期持久性,实验人员使用开始接种疫苗后 28 至 55 个月收集的 PBMC 样本检测 T 细胞应答情况。结果表明,在疫苗注射的 4.5 年后 T 细胞对曾经免疫处理过的大多数多肽仍能做出响应(图 4a)。在长时间节点上都保留有可利用的 bulk TCR 测序数据的样本中,他们检测到了 7 个同样被单细胞 TCR 测序在治疗初期和强化针注射阶段找到的 TCRα/ β 对(图 4c),在克隆水平上证明了疫苗诱导的 T 细胞在接种疫苗后还能存活数年。
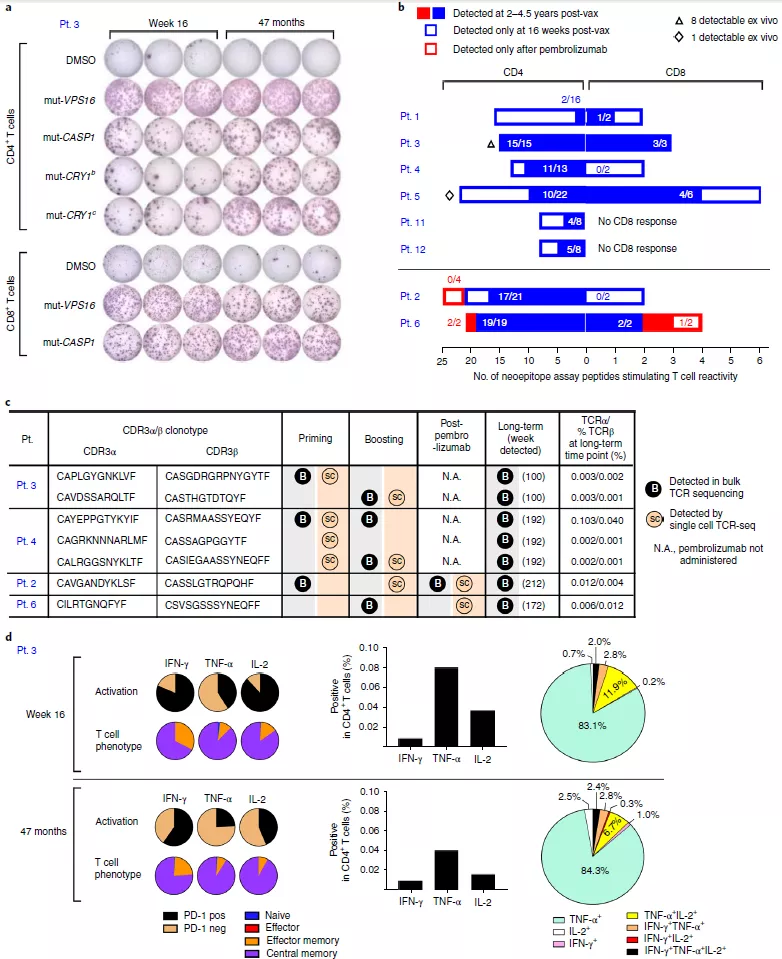
图 4 疫苗诱导的新抗原特异性 T 细胞能够存活数年
4、个人新抗原疫苗诱导 T 细胞反应的表位扩散,提示肿瘤细胞溶解
由于无法对患者直接评估疫苗介导的抗肿瘤效果,考虑到肿瘤的破坏会释放出新的肿瘤相关抗原(TAA),因此实验人员针对这些扩散开的额外抗原进行检测(图 5a)。对于 3 号病人他们共检测出 2 个非疫苗来源的新抗原(mut-EYA3 和 mut-P2RY4)(图 5b)。对于 2 号和 6 号病人,他们在 2 号病人体内检测出了 mut-AGAP3c,MAGEF,mut-AGAP3b 和 MAGED 4 个抗原(图 5c),而 6 号病人体内未观察到非疫苗肽的应答。对于 2,3 号病人,他们分别观察到 CD4+ T 细胞对已识别的非疫苗新抗原的持续应答持续到接种疫苗后 4.5 年和 4 年(图 5d)。总之,上述数据显示,在接种疫苗后早期可检测到表位扩散,在抗 PD - 1 治疗后可扩展到其他靶点,并持续数年。
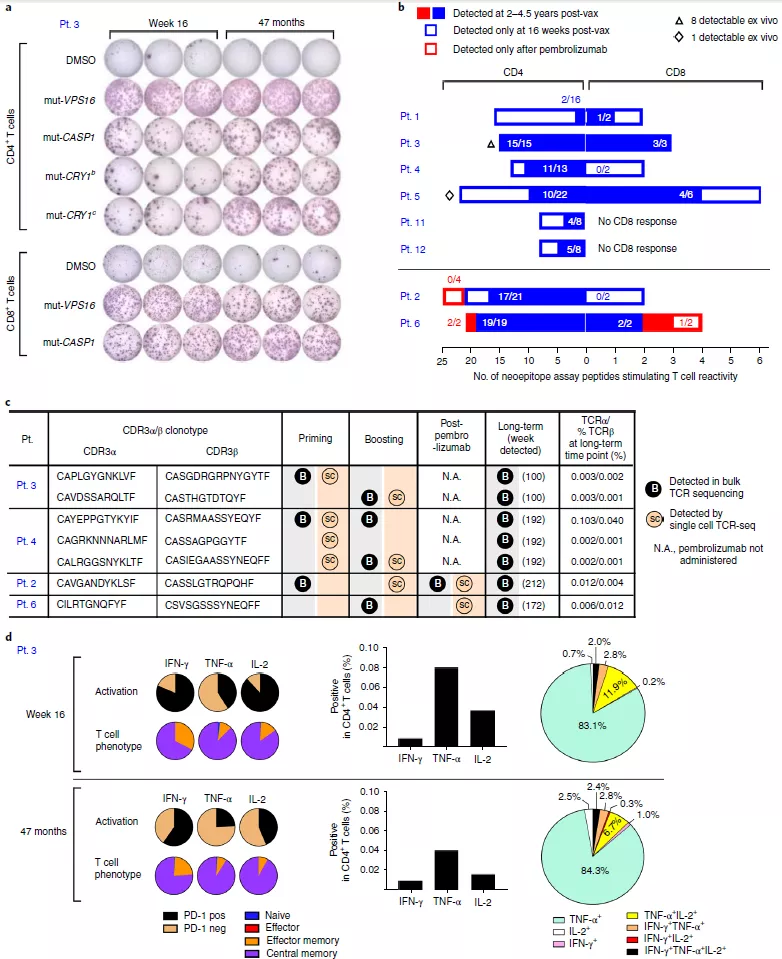
图 5 疫苗诱导的 T 细胞反应扩散到非疫苗新抗原和 TAA 表位
参考文献:
[1].Hu Z, Leet DE, Allesøe RL, Oliveira G, Li S, Luoma AM, Liu J, Forman J, Huang T, Iorgulescu JB, Holden R, Sarkizova S, Gohil SH, Redd RA, Sun J, Elagina L, Giobbie-Hurder A, Zhang W, Peter L, Ciantra Z, Rodig S, Olive O, Shetty K, Pyrdol J, Uduman M, Lee PC, Bachireddy P, Buchbinder EI, Yoon CH, Neuberg D, Pentelute BL, Hacohen N, Livak KJ, Shukla SA, Olsen LR, Barouch DH, Wucherpfennig KW, Fritsch EF, Keskin DB, Wu CJ, Ott PA. Personal neoantigen vaccines induce persistent memory T cell responses and epitope spreading in patients with melanoma. Nat Med. 2021 Mar;27(3):515-525. doi: 10.1038/s41591-020-01206-4. Epub 2021 Jan 21. PMID: 33479501; PMCID: PMC8273876.

