研究背景
牛奶是日常不可缺少的高营养动物蛋白产品,全球人均奶年消费量超过 100 公斤 / 年。许多因素都会影响奶牛的牛奶产量和质量,包括遗传,管理和饲料喂养方式,据广泛报道牛奶产量通常与牛奶蛋白质含量呈负相关。然而,根据研究者的发现,在相同的饮食和管理条件下饲养的奶牛,一些奶牛可以同时产生高产奶量和高乳蛋白含量的牛奶(MPY)。这是一个潜在的新性状,乳制品生产商可能可以利用潜在的特性提高优质牛奶的产量。目前还不清楚瘤胃微生物及其代谢产物以及宿主代谢在多大程度上对 MPY 有贡献。在此,研究者通过瘤胃代谢组学和代谢组学的分析,结合血清代谢组学,从瘤胃微生物组和宿主水平确定了 MPY 潜在的调控机制。
实验方法
检测方法:宏基因组测序 + 代谢组
实验仪器:Illumina Hiseq 3000(PE150)+ GC-TOF-MS
样本分组:HH(高 MPY) 组 =10 例,LL(低 MPY) 组 = 10 例
有 4 个样品(HH 样品 3 个,LL 样品 1 个)因提取 DNA 含量低而放弃
主要结果
瘤胃宏基因组分析
通过数据比对发现瘤胃宏基因组包括 94.43% 的细菌、3.80% 的真核生物、1.41% 的古细菌和 0.16% 的病毒。
比较了两个 MPY 组的瘤胃微生物群,古生菌在两组间差异显著(P <0.01,图 1A)。PERMANOVA 分析表明,细菌和古生菌均存在显着差异(P <0.01)。PCoA 分析显示两个 MPY 组之间基于细菌(图 1B)和古生菌(图 1C)的分离,未发现基于真核或病毒的分离。因此,两组动物之间瘤胃微生物分类群的下游比较仅集中于细菌和古生菌。
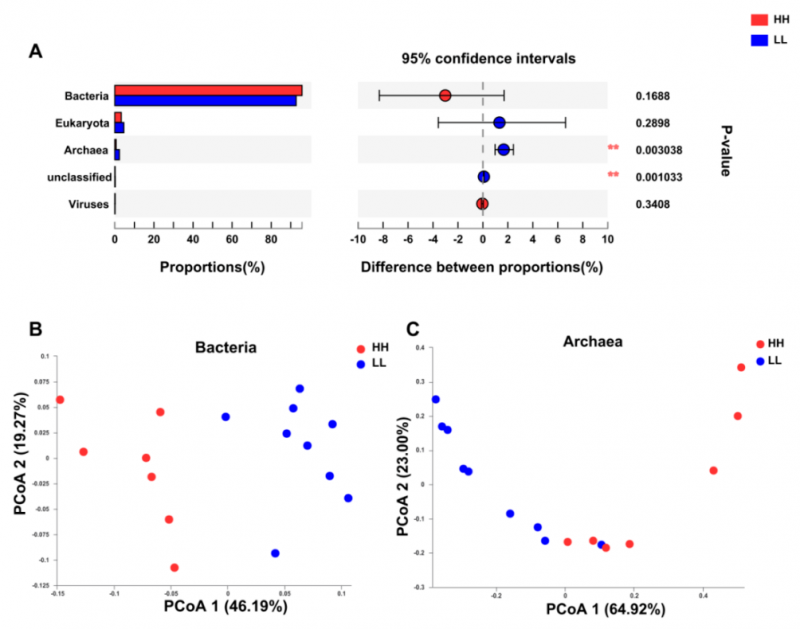
图 1 HH 和 LL 奶牛的微生物组成特征
HH 与 LL 奶牛瘤胃微生物群落组成特征及分类学差异
在细菌门水平的差异丰度比较分析中,LL 奶牛的瘤胃中拟杆菌门的丰度明显更高,而 HH 奶牛的瘤胃中,变形杆菌门的含量显着更高(调整后 P <0.05)。在种的水平上,15 个种在 HH 动物瘤胃中的丰度显著高于 LL 动物(LDA>2,P<0.05),23 种未分类拟杆菌在 LL 动物瘤胃中显著富集(LDA>2,P<0.05;图 2A)。
在古菌的差异丰度比较分析中,LL 牛瘤胃中丰富的广古菌门的丰度显著高于 LL 牛(P<0.01)。在属的水平上,LL 牛瘤胃中古细菌属甲烷短杆菌的丰度显著高于 HH 牛(P<0.01);在种的水平上,LL 牛瘤胃中 Methanobrevibacter millerae 丰度显著高于 HH 牛 (LDA>2,P<0.05;图 2B)。
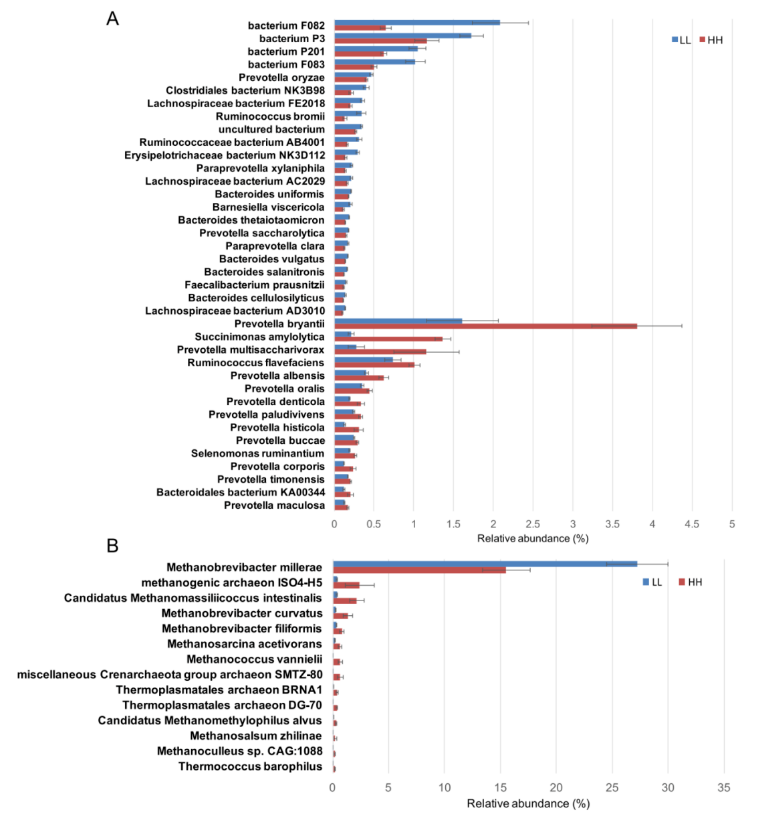
图 2 HH 和 LL 牛瘤胃细菌和古生菌种的差异
HH 和 LL 奶牛瘤胃微生物群功能特征及其差异性研究
在 KEGG 分析中,158 条内源性三级通路被认为是瘤胃微生物代谢通路。这些通路属于 4 个一级类别,包括“代谢”(72.26±0.46%)、“遗传信息处理”(19.08±0.12%)、“环境信息处理”(4.42±0.03%) 和“细胞过程”(4.24±0.04%)。在二级类别中,共观察到 20 种类别,其中“碳水化合物代谢”(17.33±0.10%)、“氨基酸代谢”(15.96±0.11%)、“核苷酸代谢”(9.82±0.06%)、“复制与修复”(8.71±0.06%)、“能量代谢”(8.07±0.05%) 较为丰富。
比较已鉴定的 KEGG 通路时发现 HH 奶牛瘤胃微生物群显著富集的有 13 条三级通路,其中 2 条是“细胞过程”通路,2 条是“遗传信息处理”通路,2 条是“环境信息处理”通路,7 条是“代谢”通路。而 18 条通路(包括 1 条“遗传信息处理途径”、2 条“细胞过程途径”和 15 条“代谢途径”)在 LL 动物的瘤胃中显著富集(LDA>2 和 P <0.05;图 3A)。当比较上述不同的三级通路中涉及的 KEGG 模块时,发现了 24 个 HH 富集的模块和 19 个 LL 富集的模块(图 3B)。
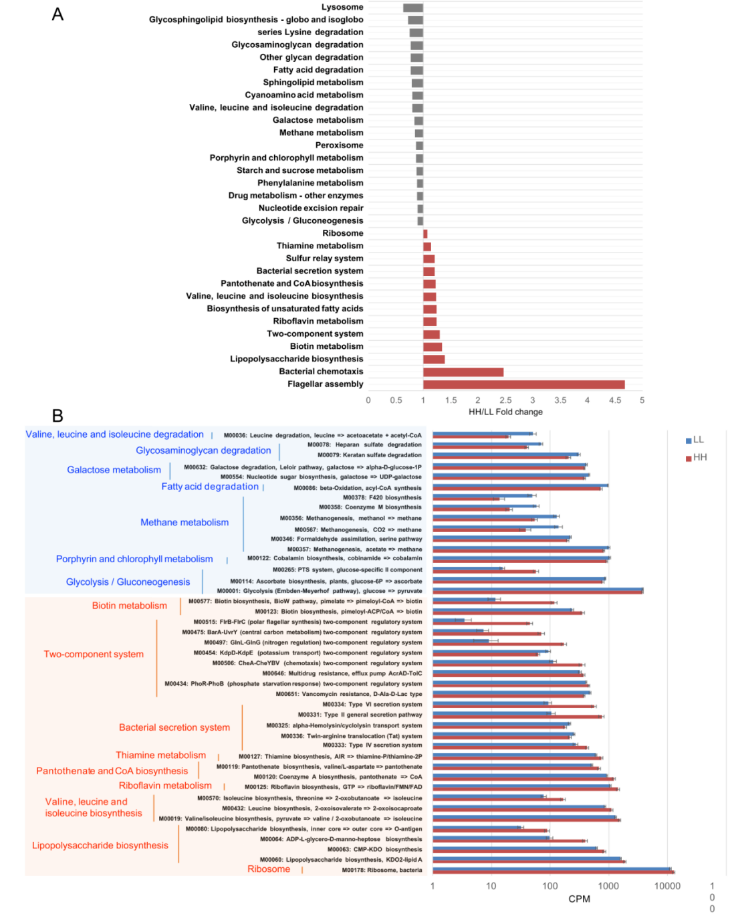
图 3 HH 和 LL 牛 KEGG 功能的差异
关于碳水化合物代谢和能量代谢,只有两种下游功能(Ko00290 和 M00019,将丙酮酸转化为缬氨酸和异亮氨酸)在 HH 奶牛的瘤胃中富集(图 4A)。4 条通路和 2 个模块在 LL 动物瘤胃中显著富集(LDA>2,P<0.05)。这 4 条通路包括“糖酵解”(Ko00010)、“淀粉和蔗糖代谢”(Ko00500)、“半乳糖代谢”(Ko00052) 和“甲烷代谢”(Ko00680)。这 2 个模块是“糖酵解”(M00001) 和“半乳糖降解”(M00632)。“缬氨酸、亮氨酸和异亮氨酸降解”(Ko00280) 的下游功能也在 LL 牛的瘤胃中富集(图 4B)。
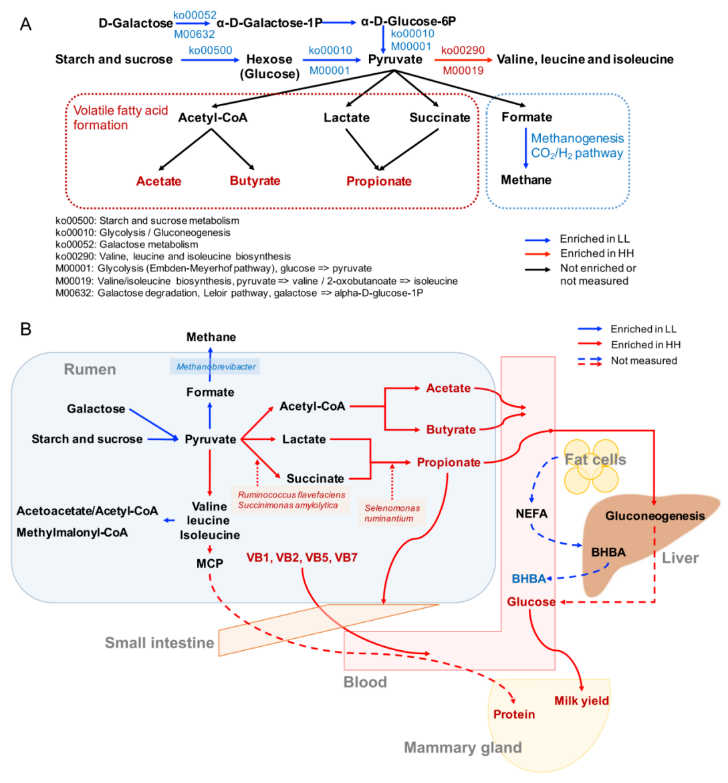
图 4 HH 和 LL 奶牛瘤胃碳水化合物代谢和能量代谢的微生物功能和种类
CAZyme 研究中,共鉴定出 313 个编码 CAZymes 的基因,包括 8 个辅助活性(AAs),79 个碳水化合物结合模块(CBMs),16 个碳水化合物酯酶(CEs),115 个糖苷水解酶(GHs),74 个糖基转移酶(GTs)和 21 种多糖裂解酶(PLs)。其中编码 GT2(8.64±0.04%)的基因占主要,其次是编码 CE1(4.66±0.02%),GT4(4.34±0.02%),GH2(4.30±0.02%)和 GH3(4.16± 0.02%)的基因。
在涉及解构碳水化合物(包括纤维素,半纤维素,淀粉,蛋白质和木质素)编码 CAZymes 的基因中,18 种在 HH 奶牛的瘤胃中富集(15 GH、1 CE、1 PL 和 1 AA),而 34 种在 LL 奶牛的瘤胃中富集(27 GH、4 CE、2 PL 和 1 AA)。
在 GTs(涉及碳水化合物的合成)中,有 11 种在 HH 奶牛的瘤胃中富集,而有 2 种富在 LL 奶牛的瘤胃里富集。
关于 CBMs,涉及复杂碳水化合物降解相关的非催化型酶,在 HH 牛的瘤胃中富含 3 种,而在 LL 牛的瘤胃中富含 19 种。
微生物种类与功能的关系
由于蛋白质含量是 MPY 的决定性指标之一,因此研究者更多的关注在瘤胃微生物组中氨基酸代谢的功能。研究发现涉及支链氨基酸(BCAA)代谢的 2 个重要通路(图 5A):“缬氨酸,亮氨酸和异亮氨酸的生物合成”(ko00290)和“缬氨酸,亮氨酸和异亮氨酸的降解”(ko00280)。对这 2 条通路的编码酶基因丰度进行了比较,结果表明,HH 牛瘤胃中参与支链氨基酸生物合成的编码酶基因丰度均显著高于 LL 牛(P<0.05),而参与支链氨基酸降解的编码酶基因丰度在 LL 牛瘤胃中均显著升高(P<0.05)。
细菌种类与这两条支链氨基酸通路之间的 Spearman 相关性网络的建立,以探讨瘤胃细菌种类对微生物支链氨基酸功能的影响。共有 24 个种与 2 条支链氨基酸途径有显著的相关性(R>0.50,P<0.05),13 个种与支链氨基酸生物合成途径(Ko00290) 呈正相关。在 13 个菌种与 Ko00290 之间的正相关中,较强的是包括 P.multisaccharivorax, P. histicola, P. maculosa, P. buccae, 以及 P. albensis 在内的 5 种普氏杆菌属(图 5B)。
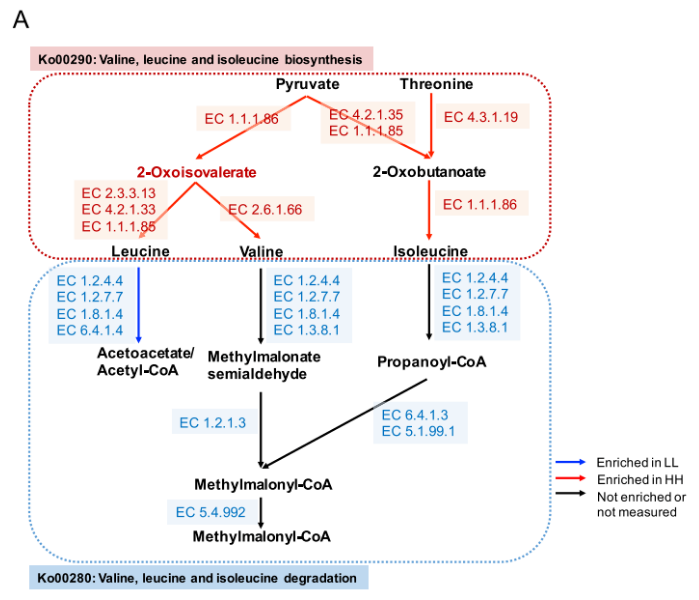
图 5A 支链氨基酸的生物合成和降解途径
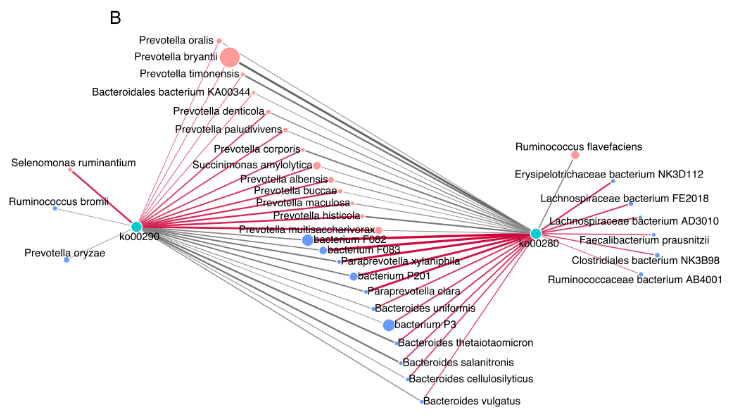
图 5B 显著不同的菌种与 2 条支链氨基酸途径之间存在关联的相关网络图
代谢组分析
在瘤胃代谢物中共鉴定出 263 种化合物。对瘤胃代谢物的相对浓度进行 t 检验和 VIP 筛选后,25 种代谢物在两个 MPY 组间差异显著(P<0.05,VIP>1;图 6A),HH 牛瘤胃中 25 种代谢物的相对浓度显著高于 LL 组(P<0.05,VIP>1;图 6A)。基于这 25 种显著不同瘤胃代谢产物的代谢通路分析(MetPA) 显示,有 10 条通路富集(图 6B),其中“维生素 B6 代谢”、“甘油脂代谢”和“β- 丙氨酸代谢”是显著不同的通路(FDR<0.01,pathway impact>0.1)。
瘤胃代谢组还用于表型(MPY) 关联分析,检测到 126 个与 MPY 相关的代谢型。126 个 MPY 代谢型用于 PERMANOVA 分析,其中 106 个 MPY 代谢型(均为 MPY 阳性代谢型)与瘤胃菌群变化相关(P<0.05)。这 106 个 MPY 阳性代谢型被认为是瘤胃微生物组响应的代谢型,然后发现它们与 43 个微生物模块显著相关(P<0.05)。除了代谢组学鉴定的瘤胃小分子的相对浓度外,还量化了总挥发性脂肪酸(VFAS)、丙酸、戊酸和异戊酸的 JUé对浓度(图 6C,D),并在 HH 奶牛中得到了显著的提高(P<0.05)。
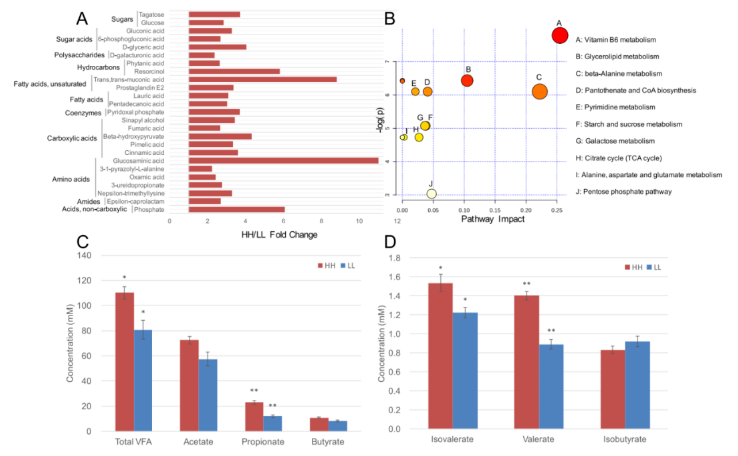
图 6 HH 牛和 LL 牛的瘤胃代谢组
对于血清代谢组,研究者分析了先前研究中鉴定的 176 种化合物。比较分析表明,HH 奶牛血清中 19 种代谢物的相对浓度明显更高(P<0.05),LL 奶牛血清中 12 种代谢物的相对浓度显着升高(P<0.05,VIP>1;图 7A)。
将上述 31 种不同浓度的代谢物用于 MetPA 分析,揭示了 12 条通路的富集(图 7B),其中“甘氨酸、丝氨酸和苏氨酸代谢”、“烟酸和烟酰胺代谢”、“鞘脂代谢”、“氨基酰 tRNA 生物合成”和“缬氨酸、亮氨酸和异亮氨酸降解”是显著不同的通路(FDR <0.01, pathway impact>0.1)。
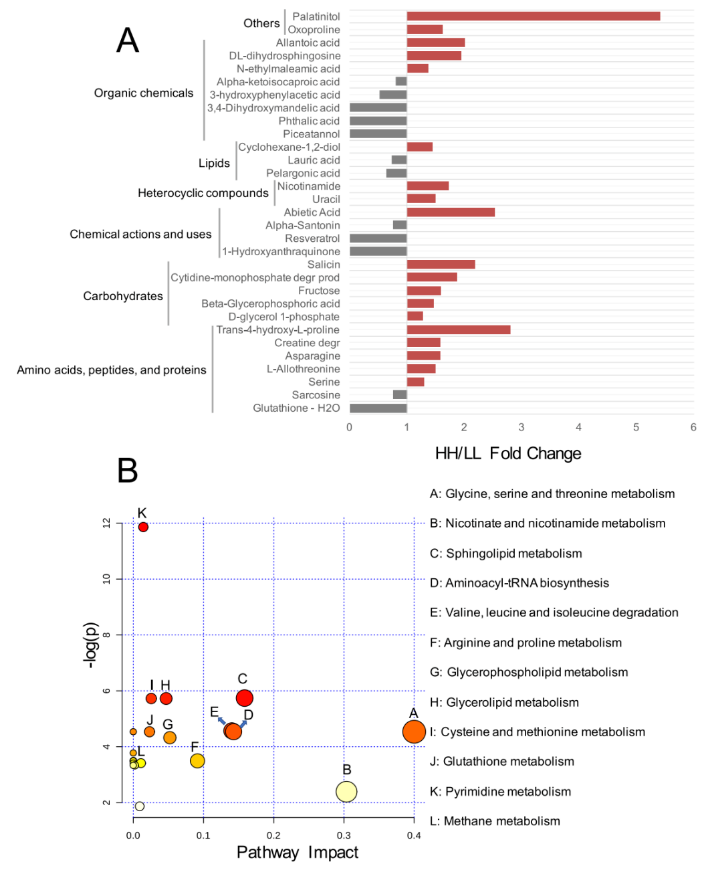
图 7 HH 和 LL 牛的血清代谢组
将血清代谢组用于表型(MPY) 关联分析,将血清代谢物鉴定为 MPY 阳性代谢型(21 种代谢物)或 MPY 阴性代谢型(14 种代谢物)。
为了确定瘤胃和血清中的 MPY 相关代谢物是否相关,研究者比较了瘤胃和血清中的代谢物,包括两个 MPY 组之间显著差异的代谢物、MPY 阳性代谢型和 MPY 阴性代谢型等。差异代谢物的 Venn 图显示,月桂酸的脂肪酸是瘤胃和血清共有的(图 8A)。对于差异代谢通路,HH 奶牛瘤胃和血清中的“嘧啶代谢”、“甘油脂代谢”和“淀粉和蔗糖代谢”三个途径是共有的(图 8B)。MPY 相关代谢型的 Venn 图显示,“精氨酸和脯氨酸代谢”、“氨基酰基转移酶合成”和“嘌呤代谢”是瘤胃和血清 MPY 阳性代谢型共有的(图 8C)。
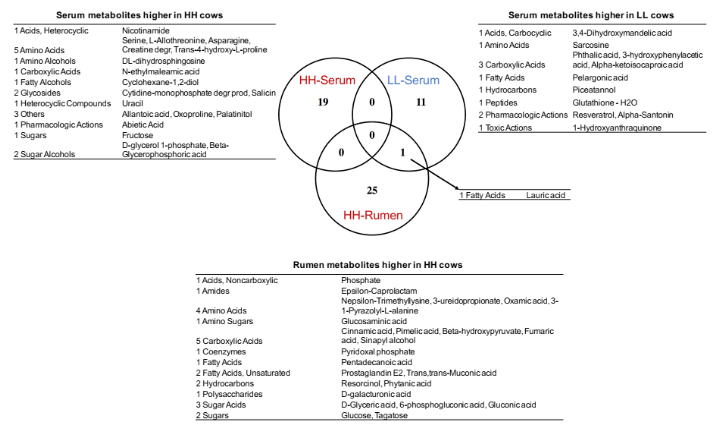
图 8A Venn 图显示不同 MPY 组之间瘤胃和血清中的代谢物存在显著差异。
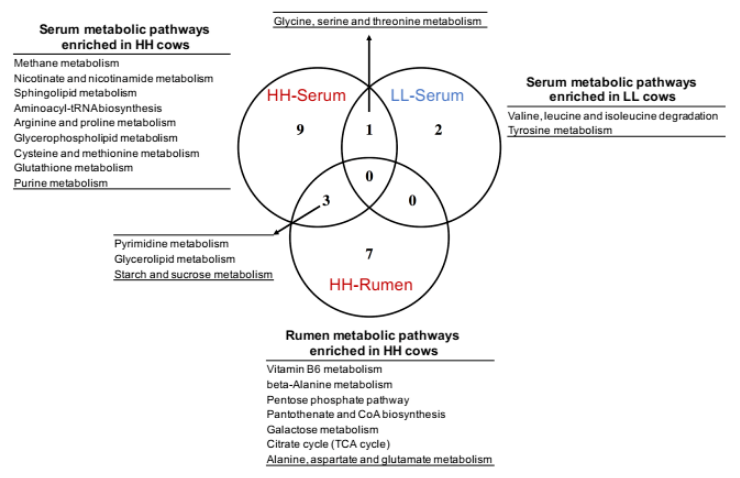
图 8B Venn 图显示关键通路(基于显著差异的代谢物而富集)
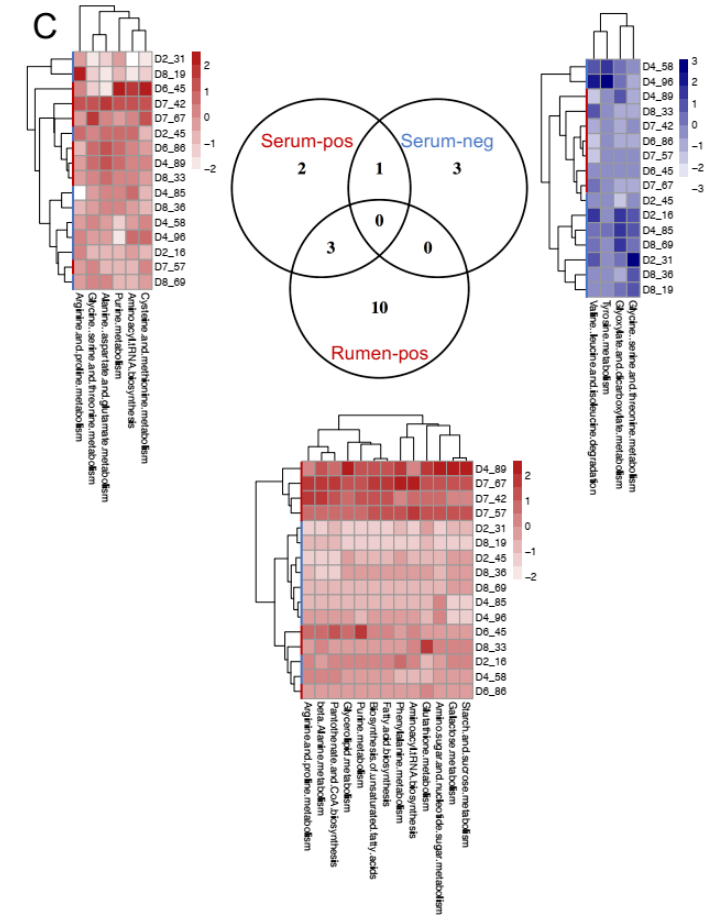
图 8C Venn 图显示瘤胃和血清中存在 MPY 阳性和 MPY 阴性代谢产物热图显示每个样本中每个代谢物集的 Z 分数转换丰度
瘤胃微生物组,瘤胃代谢组和血清代谢组之间的关系及其对 MPY 的解释性
瘤胃微生物群与瘤胃代谢产物之间的 spearman 相关性分析:结果显示有 65 个显著相关(R>0.50,P<0.05;图 9A)。在 65 种相关性中,主要 11 个种普氏菌种与氨基酸、多肽、蛋白质、有机化学物质呈正相关(0.50
瘤胃微生物群和血清代谢物之间的 Spearman 相关性分析(图 9B):与瘤胃微生物群和瘤胃代谢产物之间确定的关系相比,存在的关系较少。瘤胃微生物群与血清 MPY 相关的代谢型之间的关系表明,7 个普氏菌种参与几种氨基酸代谢的代谢型呈正相关,这些氨基酸包括甘氨酸,丝氨酸,苏氨酸,丙氨酸,天冬氨酸,谷氨酸,半胱氨酸和蛋氨酸(图 9D)。

图 9 瘤胃代谢组、代谢组和血清代谢组之间的相互作用
利用线性混合效应模型进一步分析了瘤胃微生物组成、功能、代谢产物和血清代谢产物对宿主 MPY 的贡献率分别为 17.81%、21.56%、29.76% 和 26.78%(图 10)。
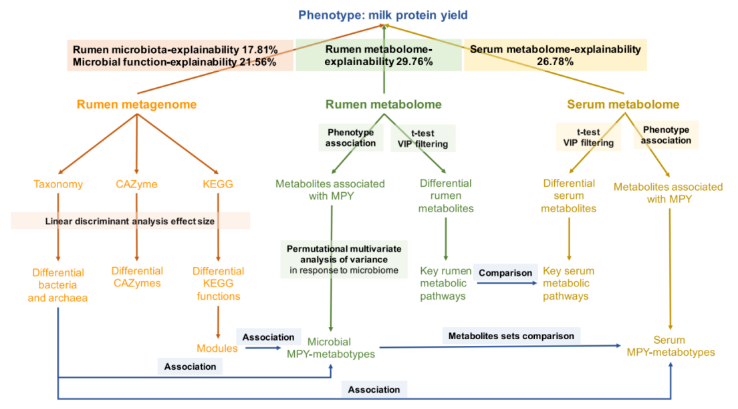
图 10 本研究流程图
结论
这些发现为在相同管理条件下微生物组依赖性和寄主依赖性机制如何促进奶牛产奶质量的不同个性化表现提供了基本理解。这些基本信息对于开发通过高精度喂养提高牛奶质量和产量的潜在操作策略至关重要。
参考文献:Ming-Yuan Xue, Hui-Zeng Sun, Xue-Hui Wu, et al. Multi-omics reveals that the rumen microbiome and its metabolome together with the host metabolome contribute to individualized dairy cow performance. Microbiome.2020; 12;8(1):64
更多伯豪生物服务


