 |  |

人类基因组测序开展的数十年以来,研究人员建立了遗传因素与许多 Jí 病之间的联系。但是,编码 基因组 DNA 的核苷酸只是遗传因素中影响细胞功能和整体健康的一部分,表观遗传学(指在某些情况下 不修改 DNA 序列而发生的可遗传的改变)也具有重要功能。DNA 甲基化是一种已经过大量研究的表观遗传学标记,其可化学修饰胞嘧啶和腺嘌呤。胞嘧啶甲基化常发生在基因组中的 CG 序列,称为 CpG 位点,它以细胞特异性的方式广泛地调控基因表达。全基因组关联研究 (GWAS) 将 DNA 甲基化的改变与复杂病例如癌症和肥胖以及复杂的生物学状态例如衰老和发育联系起来 [1,2]。近年来甲基化测序已扩展到基因表达之外,开始在 Jí 病诊断中获得关注 [1,3-5]。近期研究表明差异甲基化是癌症检 Cè 中信息丰富且 灵敏的标记,不论甲基化是否与基因表达相关 [6]。
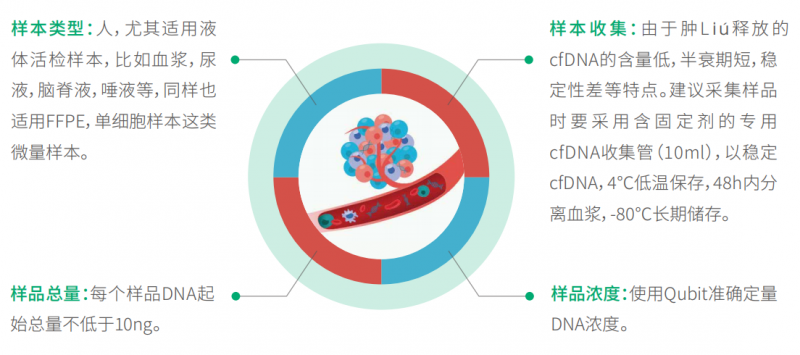
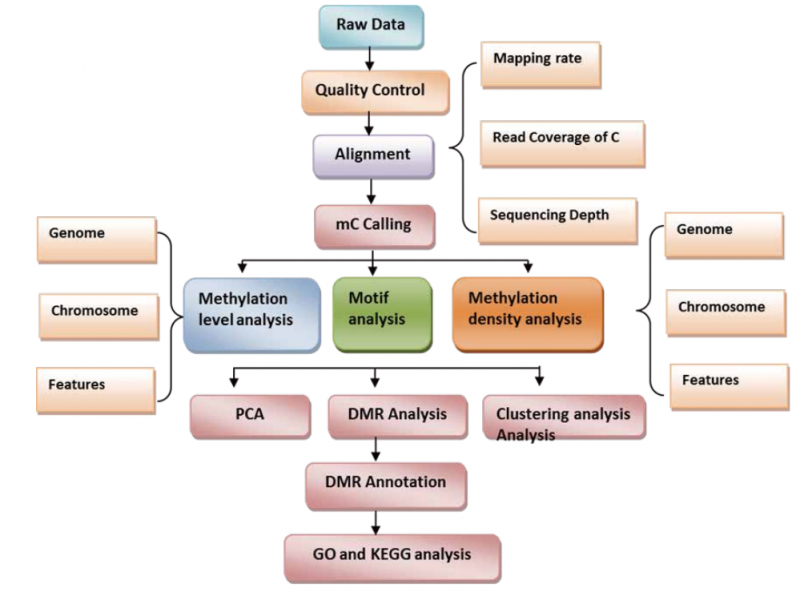
目前,DNA 甲基化在癌症液体活检(如 cfDNA)中已经有很多相关研究,并受到越来越多的关注。常 见的 DNA 甲基化研究手段都是基于亚硫酸氢盐(化学试剂)的转化,这种方法很剧烈,对 DNA 损伤严重,对 DNA 起始量有着较高要求。而血液 cfDNA 的含量通常很低,只有几十 ng,普通的亚硫酸氢盐测序手段很难满足。因此伯豪生物引进 EM-seq(Enzymatic methyl sequencing),该技术基于酶学温和转化,可实 现 DNA 甲基化位点的单碱基分辨率,适用于癌症早筛液体活检样本的标志物研究(如:血浆 cfDNA,尿液 cfDNA,脑脊液 cfDNA 等)也适用于研究细胞分化的单个细胞超微量样本(如:卵母细胞,精母细胞,胚胎等)。EM-seq 提供了稳健的全流程完整解决方案,用于识别人类基因组中的甲基化区域。文库制备过程 中,采用独特的酶促转化,它对脱氧核糖核酸(DNA) 的损害小得多,需要的样本输入更少,从而获得更高 质量、性能更好的文库。Twist 自定义甲基化探针组合设计为 CpG 检 Cè 提供了有效特别的探针,用于靶向富集。优化的杂交试剂增加了工作流程的时间灵活性,并提高了中靶率。甲基化测序涉及酶或化学方法,这些方法可使未甲基化的胞嘧啶通过一系列反应,通过脱氨基 转化为尿嘧啶,而甲基化的胞嘧啶则 保持完整(图 1)。在扩增过程中,尿嘧啶对应的互补链上会互补配对加上腺嘌呤,造成未甲基化的胞嘧啶的原始位置引入胸腺嘧啶。如图所示序列终产物是不对称的,转化后形 成两条不同的双链 DNA 分子(图上);对于甲基化的 DNA,同样的过程则产生另外不同序列(图下)。
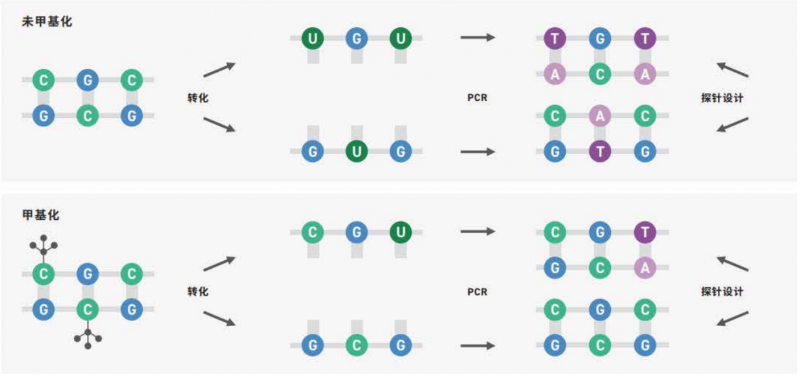
▲图 1

产品优势
1、酶转化 Zuì大限度降低 DNA 损坏,超低 DNA 起始量要求,低至 10ng;
2、卓越的比对率,GC 均一性;
3、高灵敏度,分辨率可达到单个碱基;
4、相比亚硫酸氢盐方法检 Cè 可多检 Cè 15% 的甲基化位点;
5、灵活适用不同靶向区域。
目录化产品
人(hg38)的 134Mb 设计长度(覆盖约 400 万 CpG 位点),基于新的 UCSC, Ensembl, ENCODE 等新的数据库,关注那些已知甲基化可影响基因调节的区域:57% CpG open seas (interCGI), 21% CpG island shores, 15% CpG islands, 8% CpG island shelves。


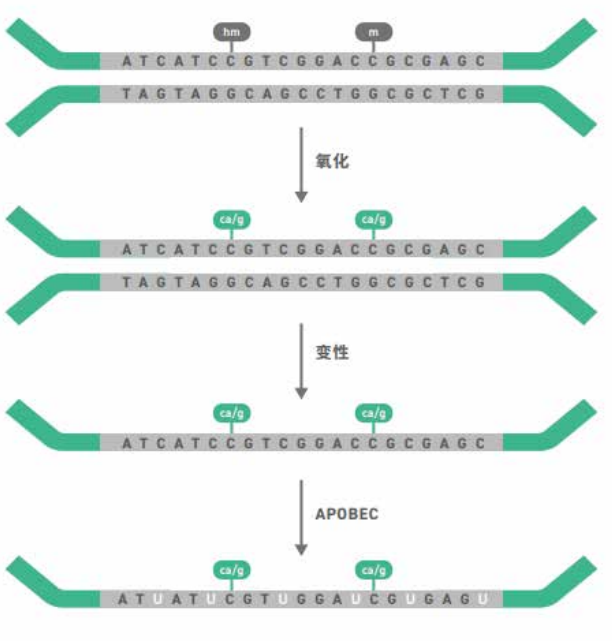
▲图。EM-seq 转化涉及一系列酶反应,以识别未甲基化胞嘧啶。
在 Dì 一次反应期 间,10-11 易位双加氧酶 2(TET2) 将甲基 化胞嘧啶(5mC 和 5hmC)转化为 5 - 羧基 胞嘧啶(5caC) 以及氧化增强剂葡糖苷 酸 5hmC(5ghmC)。这些反应保护 5mC 和 5hmC 免受下游脱氨作用。然后,在 APOBEC 将胞嘧啶脱氨至尿嘧啶之前, 使 DNA 变性。随后的聚合酶链式反应 (PCR) 扩增将修饰的 5mC 或 5hmC 转化 为胞嘧啶,并将尿嘧啶转化为胸腺嘧啶。PCR 后,核酸序列与重亚硫酸盐转化的 序列一致,使得 EM-seq 与现有分析流程 (如 Bismark 和 bwa-meth)相兼容。
酶法的高效转化
| 指标 | 末甲基化 Lambda DNA | CpG 甲基化 pUC19 DNA |
| 预期转化效率 | ≥99.5% | ≥99.5% |
| 实测转化效率 | 99.77% | 99.57% |
| 预期 CpG 甲基化水平 | 约 0.5% | 95-98% |
| 实测 CpG 甲基化水平 | 0.22228% | 95.7572% |
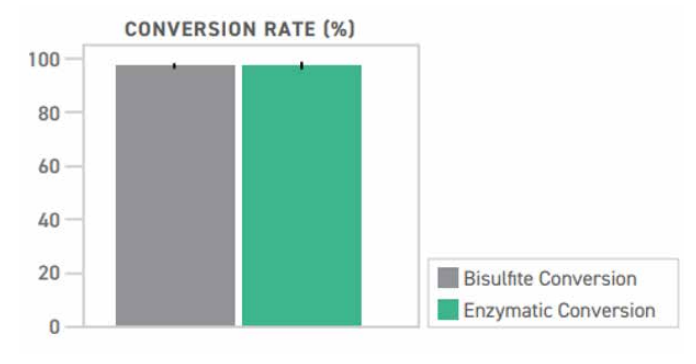
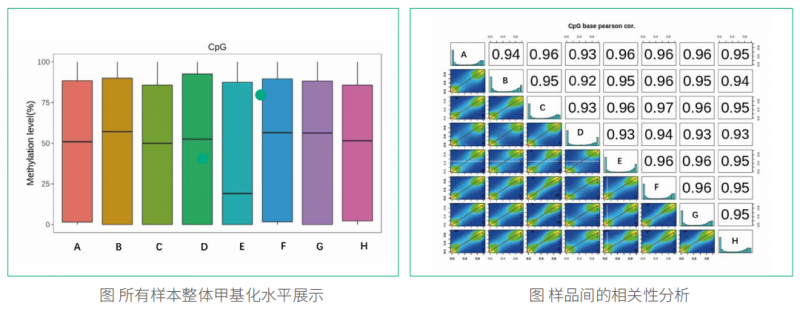
在 EM-seq 和 BS-seq 中,酶和亚硫酸氢盐都是将未甲基化的胞嘧啶转化为胸腺嘧啶,且转化效率接近。选择 CpG 甲基化的 pUC19 DNA 和未甲基化的 Lambda DNA 这种已知甲基化 DNA 作为质控对象,结果显示,两种文库转换方法的转化率均达到 99.5%,以胞嘧啶在非 CpG 位点转化为胸腺嘧啶的百分比来测量。







1、Jones PA. Functions of DNA methylation: islands, start sites, gene bodies and beyond. Nat Rev Genet 2012; 13: 484-492.
2、Yang X, Shao X, Gao L, Zhang S. Comparative DNA methylation analysis to decipher common and cell type-specifific patterns among multiple cell types. Brief Funct Genomics 2016; 15: 399-407.
3、Loh M, Zhou L, Ng HK, Chambers JC. Epigenetic disturbances in obesity and diabetes: Epidemiological and functional insights. Mol Metab 2019; 27S: S33-S41.
4、Ferrucci L, Gonzalez-Freire M, Fabbri E et al. Measuring biological aging in humans: A quest. Aging Cell 2020; 19: e13080.
5、Perez RF, Santamarina P, Tejedor JR et al. Longitudinal genome-wide DNA methylation analysis uncovers persistent early-life DNA methylation changes. J Transl Med 2019; 17: 15.
6、Locke WJ, Guanzon D, Ma C et al. DNA Methylation Cancer Biomarkers: Translation to the Clinic. Front Genet 2019; 10: 1150.
7、Liu MC, Oxnard GR, Klein EA et al. Sensitive and specifific multi-cancer detection and localization using methylation signatures in cell-free DNA. Ann Oncol2020; 21: 745-759.
8、Vaisvila R, Ponnaluri VKC, Sun Z et al. Enzymatic methyl sequencing detects DNA methylation at single-base resolution from picograms of DNA. Genome Res 2021.

