文章标题:Patient-derived organoids for personalized gallbladder cancer modelling and drug screening
发布期刊:Clinicaland Translational Medicine(CTM)
影响因子:IF 11.492
提供服务: 单细胞测序技术由上海伯豪生物技术提供。
简介:
近日,信号转导国际合作实验室联合肝癌信号调控与靶向治疗教育部重点实验室及上海市肝胆肿瘤生物学重点实验室、第二军医大学东方肝胆外科医院的通讯付静老师等研究团队在 Clinicaland Translational Medicine(CTM)上发表了名为“Patient-derived organoids for personalized gallbladder cancer modelling and drug screening”的研究文章以探索胆囊肿瘤分子发病机制和发现个性化药物的有用平台。
胆囊癌(GBC)是常见的胆道癌类型,并被列为第六大常见的胃肠道恶性肿瘤。GBC 的发病率在世界范围内显示出区域差异,在发达国家并不常见,但在发展中国家的某些特定地理区域很常见。GBC 的总体预后非常差。手术切除是特有可以治愈局限性 GBC 患者的方法,但复发率可高达 65%。辅助治疗策略,包括化疗、放疗或联合治疗,用于改善晚期 GBC 患者的预后。然而,在许多患有这种高度异质性肿瘤的患者中,治疗反应并不令人满意。迫切需要开发更加个性化和靶向的疗法。开发新疗法的主要障碍之一是缺乏适当的模型来准确概括人类癌症的组织学复杂性和遗传异质性。
由于手术标本中可用的材料有限,胆囊肿瘤模型通常难以生成。为了全面模拟胆囊肿瘤的全临床范围,研究人员从 41 名未经治疗的 GBC 患者和 5 名未经治疗的 GBA 患者中收集了手术切除的肿瘤组织。开发了胆囊肿瘤的 3D 培养方案,成功建立了 5 个 GBC 类器官系和 2 个 GBA 类器官。
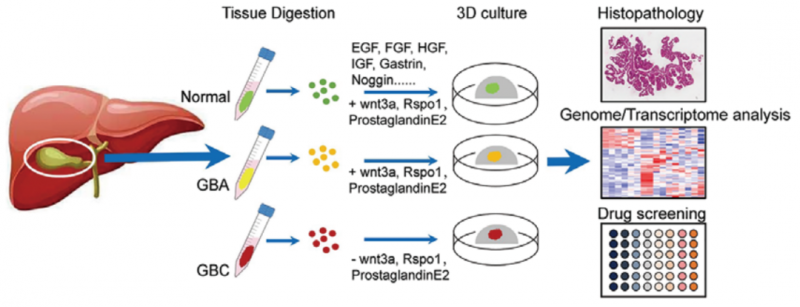
为了验证类器官培养物在肿瘤内异质性的可重复性,研究人员使用三个样品生成了基于液滴的单细胞 RNA 测序(sc-RNA seq)谱:GBA- 2 组织(GBA-2_T),GBC- 4 组织(GBC-4_T)和匹配的 GBC- 4 类器官(GBC-4_O)。经过质量控制和双层去除,研究人员总共获得了 7124 个单细胞。在基因表达归一化之后,研究人员采用 UMAP 方法来降低维度。这些细胞被分配到七个主要的不同细胞类型簇。
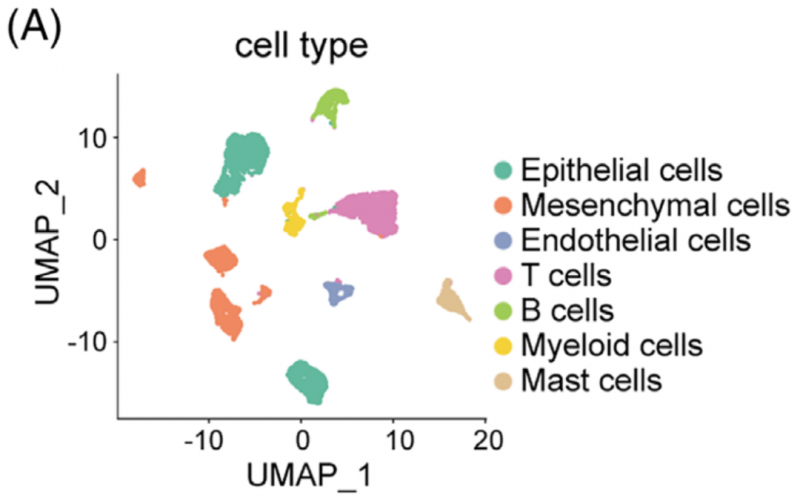
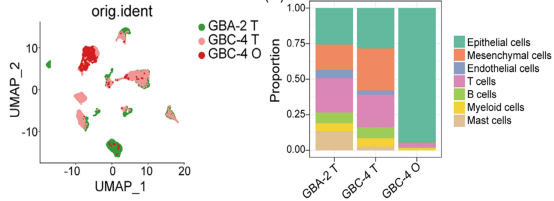
GBA-2_T 和 GBC-4_T 由不同的细胞型簇组成,而匹配的 GBC-4_O 主要由上皮细胞组成。研究人员进一步关注了样本内和样本之间上皮细胞群的异质性,上皮细胞共包括六个主要亚群。
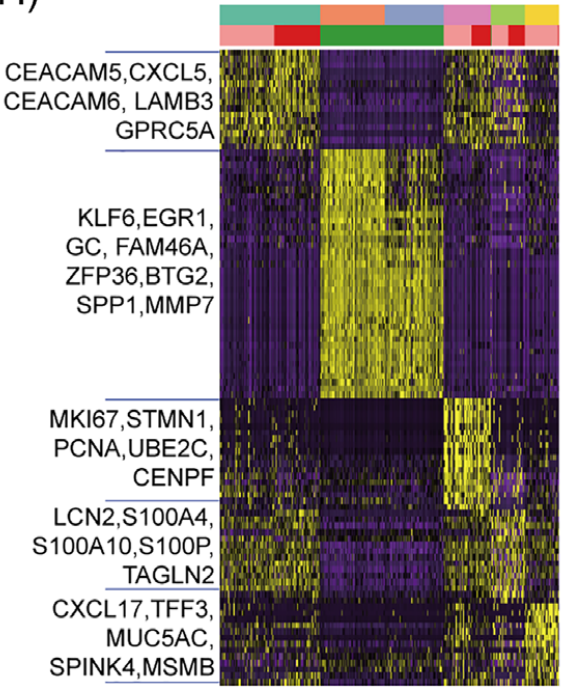
研究人员进一步进行了差异基因分析,以表征六个上皮亚群。由良性特征标记,亚簇 1 和 2 同样过度表达代谢相关基因和肿瘤抑制因子(KLF6,EGR1,GC,FAM46A,ZFP36,BTG2 等)。值得注意的是,GBC‐4 组织及其相应的类器官在亚群 0,3 和 4 中具有相似的 DEGs。亚群 0 过度表达粘附和迁移相关基因(CEACAM5、CEACAM6、CXCL5、GPRC5A、LAMB3 等)。亚簇 3 过表达增殖相关基因(MKI67,STMN1,PCNA,UBE2C 和 CENPF)。亚簇 4 过表达的上皮 - 间充质过渡(EMT)相关基因(LCN2,S100A4,S100A10,S100P 和 TAGLN2)。亚群 5 明显来自肿瘤组织,过度表达粘液分泌相关基因(CXCL17,TFF3,MUC5AC,SPINK4 和 MSMB 等)。
通过推断大规模染色体 CNV,上皮细胞和良性 GBA- 2 细胞中存在多种染色体畸变谱,推断 CNV 要低得多。
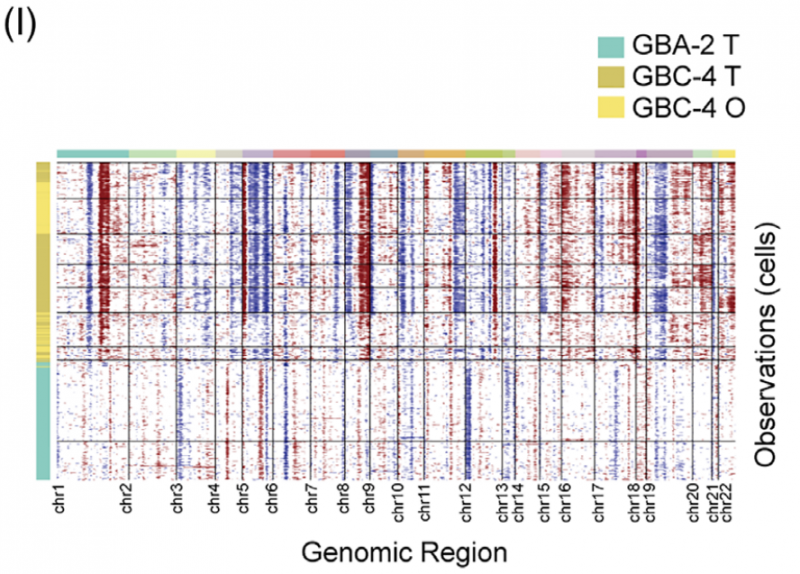
根据 INFERCNV 分析,推断出的 CNV 在 GBC- 4 组织的上皮细胞和匹配的类器官之间高度一致。综上所述,这些数据表明 GBC 衍生的类器官可以在单细胞分辨率下概括其衍生组织的转录特征和异质性。
参考文献:

