标题 : Spatiotemporal analysis of human intestinal development at single-cell resolution
期刊:Cell
影响因子:41.58
文章导读
人类对肠道发育的认知还不够完善,如果将单细胞测序和空间转录组学联合起来,人们就可以兼顾单细胞的分辨率与空间位置的准确性,从而描述肠道发育随时间变化的形态。本实验共确定了 101 种细胞形态,包括上皮和间充质细胞群和关键形态改变之间的相关性。实验人员描述了隐窝绒毛轴是如何形成的,以及神经、血管、间充质形态发生和发育中的肠道免疫群体。同时,研究人员还鉴定了发育中的成纤维细胞和肌成纤维细胞亚型的分化层次,并描述了这些亚型的不同功能。此外,他们还发现了派伊尔结和肠道相关淋巴组织(GALT)的起源,并描述了位置特异性免疫程序。利用实验得出的结论,他们提出了一个形态形成梯度的无偏性分析,直接关联连续的几波细胞分化,并确定了细胞及位置与罕见的发育性肠道疾病有关。
科学问题
肠道有着怎样的发育过程?
肠发育过程的紊乱又怎样与疾病相关?
实验设计
从 17 个胚胎中不同发育时间点与组织位置取出的共 77 个肠道样本,总计 76592 个细胞。
技术:10X genomics
实验思路
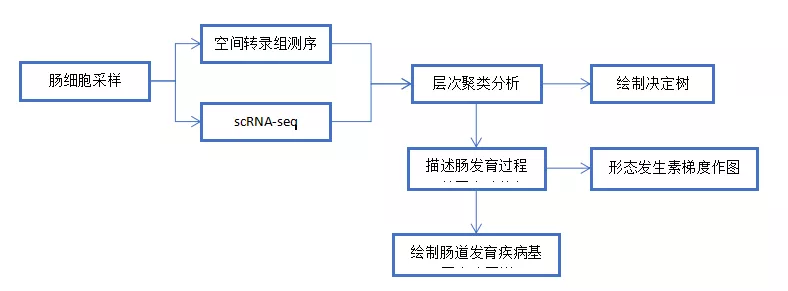
实验结果
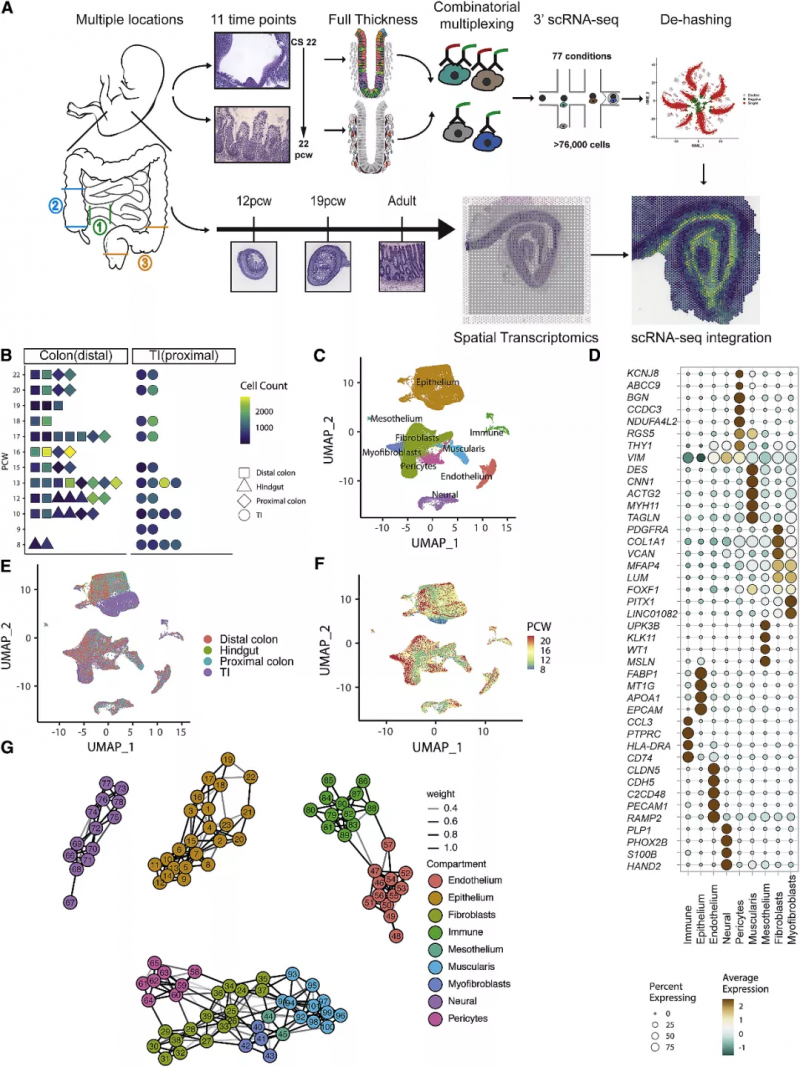
图 1 人类肠道发育的时空转录图谱
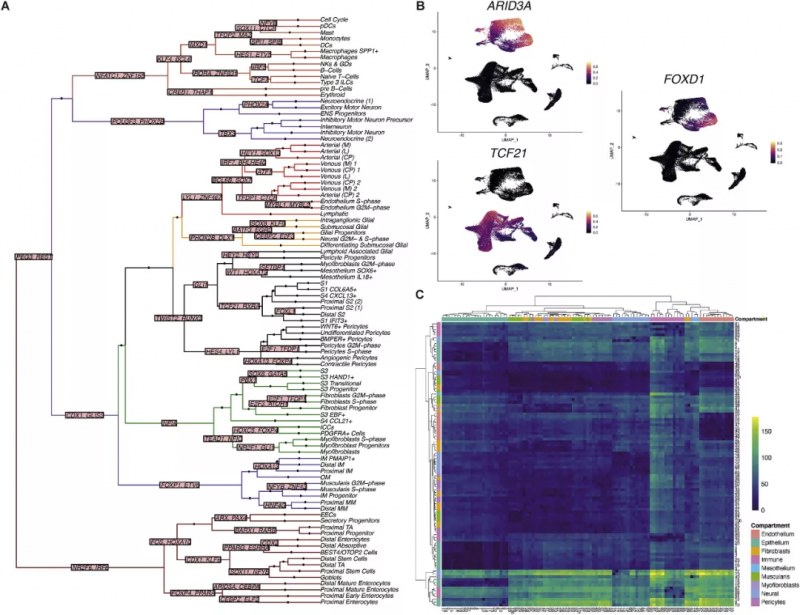
图 2 胎儿肠道发育的转录因子调控网络和受体 - 配体相互作用
1、根据发育时间和空间对 101 种肠细胞的分类
作者从代表不同发育时间点和组织位置的 17 个胚胎收集的 77 个肠道样本中 10x Genomics 的单细胞基因表达解决方案生成了 scRNA 序列图谱(图 1),经过聚类,分为 9 种肠道组成细胞(图 1C,D),并展示了它们在空间位置与发育时间的差异(图 1E,F)。通过进一步的细分,基于标志基因划分出共 101 个细胞亚群(图 1G)。接下来研究人员又基于 464 种目前已知的发育转录因子针对细胞命运绘制了“决定树”(图 2A),并对 101 个亚群的细胞进行了细胞通讯分析(图 2C),辨认假定的受体 - 配体对。
2、单细胞的空间位置
为了绘制 scRNA-seq 数据的空间分布图,作者利用 10x Genomics 的 Visium 空间转录组技术对来自整个肠道发育的组织进行了空间转录组学分析,在每张切片中确定了映射到离散位置的 5 -13 个点簇,以上述 scRNA-seq 图谱为参考,作者通过因子分析以确定每个聚点可能的单细胞组成,从而在空间上定位所有 scRNA-seq 簇(图 3A)。这种定位能够很好地描述细胞类型,例如在隐窝底部的上皮干细胞(ISCs)(图 3Ai 与 3Aii),位于平滑肌外层的 FOXF2- 肌层细胞(图 3Aiii),以及处于隐窝顶部的 BEST4/OTOP2 细胞(图 3Aiv)。图 3B 展示了隐窝顶部肠细胞与肌成纤维细胞合适的解剖学定位,RET 在肌肠丛特异表达,PTPRC (CD45) 在粘膜下淋巴滤泡特异表达。
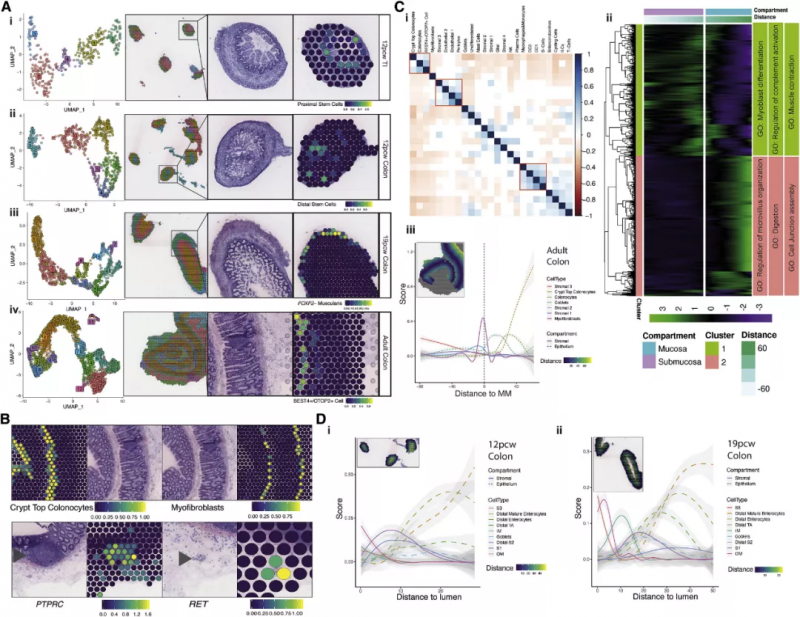
图 3 ST 和 scRNA-seq 整合的肠道发育时空分析
3、人类肠上皮细胞与 ISCs 的发育
根据细胞的吸收性、分泌性、未分化与干细胞基因特征可以很轻易地对 17622 个被捕获的上皮细胞进行区分(图 4A)。分析结果表明近端(小肠 [SI]) 和远端(结肠)样本之间有着显著位置差异,这一差异由高特异性基因表达(如 CCL25 和 APOE) 划分(图 4A 和 4B)。这表明,在隐窝形成之前,特定位置的转录程序已经在发育中建立起来。随着时间的推移,可以观察到上皮细胞的大量细胞重塑,在 12 PCW(post-conceptual weeks)之前,祖细胞 /TA 细胞占主要组成部分,很少看到成熟的吸收和分泌细胞,而在 12PCW 之后,上皮组织的组成已经与成人组织相似(图 4C)。在对 ISCs 发育的研究过程中,实验人员发现了一群近端上皮干细胞样祖细胞,进而会形成早期肠细胞。这些细胞表现出许多原始特征,包括在中胚层分化中重要的 VTN 高表达,与 ISCs 相比,LGR5 表达很少,ONECUT2 表达参与上皮发育(图 4B)。在小肠中,这些细胞独特地表达转录因子 GATA4(图 4E),在 12 周之后,这一表达又大部分丢失。这些细胞高度表达转铁蛋白(图 4B,F),证实了在绒毛形成过程中铁代谢的重要性。LGR5 是 ISC 的特征基因,在妊娠早期(<12PCW)被检测出在近端 / 远端 ISCs 及干细胞样祖细胞中广泛的低表达,即使在隐窝形态建立后(例如,19 个 PCW 后),ISCs 在远端 / 近端样本中分别占捕获的上皮细胞的平均比例为 18%-22%,高于成人结肠 scRNA-seq 研究中捕获的 3%-4%。由此实验人员发现了随发育进行的 ASCL2 转录因子模块的显著表达上升(包含下游调控目标 LGR5)。
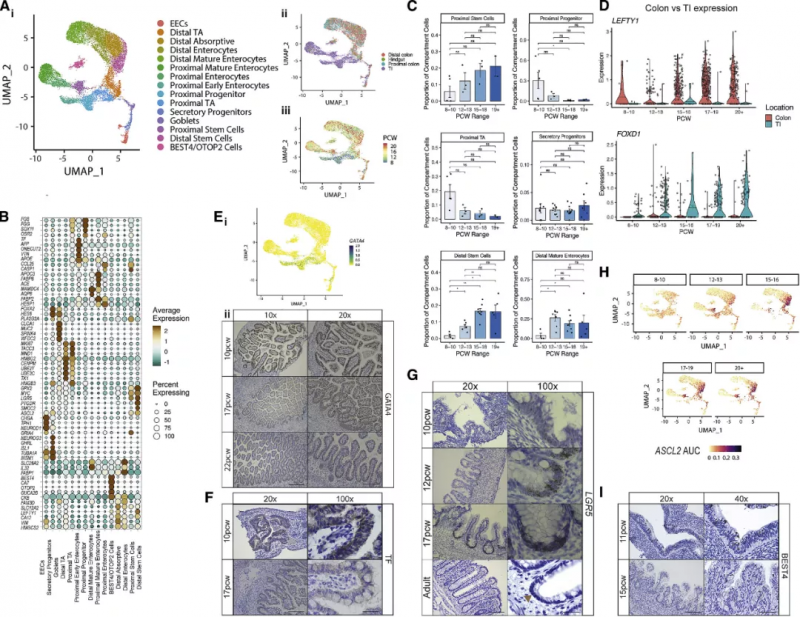
图 4 子宫上皮成熟和隐窝发育
4、肠道血管生成,神经系统和肌层固有层发生,肠固有层间充质细胞发育
如图 5A 所示上皮细胞被划分为静脉型,动脉型和淋巴型细胞,根据血管的尺寸,它们又被进一步细分。随着发育时间进程可以观察到小血管内皮细胞向大血管内皮细胞的转变,反映了肠道血管发生,驱动这一过程的转录因子网络已得到辨认,如动静脉分化因子 HEY1 和 SOX13。作为内皮细胞的补充,周细胞亚型由血管生成驱动因子(PRRX1, THBS4, and ANGPT2) 定义(图 5B)。实验人员在肠道发育的早期阶段发现了不同的神经元和胶质祖细胞,共捕获到了 5 种胶质细胞和 7 类神经细胞(图 5E)。在成年人的肠道内,神经丛被肌肉包围,图 5F 中祖细胞和分化的肠平滑肌细胞(iSMCs) 分别用 PLPP2 和 ACTA2 基因区分。他们在肠道发育过程中发现了关键的转录因子调控网络:KLF7 存在于肌细胞中,TWIST2 存在于间质和外层肌细胞中,FOXF2(该基因缺失突变会致死)特异性活化于内层肌细胞中。这一发现与平滑肌介导的机械力启动绒毛形成的可能性相一致。受测细胞中大的类群为间充质细胞,它能够支持上述的其它细胞组分。基于先前的研究结果这些细胞可被划分成 s1-s4 四个类别,再辅以时间、空间、分化周期信息,这些细胞进一步被划分为 16 个类群(图 5G)。图 5H 展示了对 s3 细胞类群的空间定位,并对几种 s3 类群的差异基因表达进行了定位,如 C7(图 5Hii)。将胎儿细胞类型标志基因对应到成人空间转录组切片上,实验人员发现 S3 HAND1+ 和 S3 EBF+ 细胞聚集在大血管周围(图 5Hiii-Hiv),概括了成年人的 S3 类群。这突出了这些细胞可能的作用,形成一个支持肠道血管的生态位。细胞通讯分析证实了这一点,ECs、周细胞和“S3”型成纤维细胞信号在同一空间位点相关(图 3Ci)。
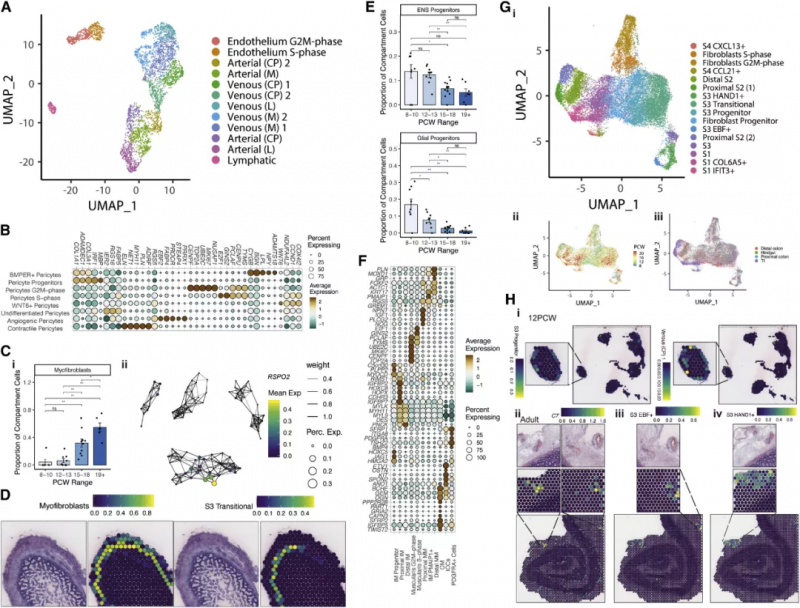
图 5 间充质和内皮间室细胞的协调发展
5、肠道发育过程中无偏差形成素梯度作图
图 6A 中展示了形成素分子的互作关系,虚线标注了富集的信号通路。基因共表达分析辨认出 11 种特异细胞类型和 13 种空间共定位形成素模块。空间模块 3 由内皮细胞、成纤维细胞和周细胞来源的形成素分子组成,包括 LRP1,位于组织深部(图 6Bi)。RSPO3 可以通过 LGR5 向 ISCs 发出信号,它在间皮 / 肌层模块中较高,在 PCW 12 之前主要可见,然后随着组织深度的增加而消失(图 6C)。这说明发育过程存在这样一种模式:随着发育中的肠道的生长,形成素分子的梯度可能会因层间物理距离的增加而被打破,但可以通过顺序发育的细胞类型的表达来恢复。
6、S2 成纤维细胞具有空间位置特异性并控制上皮模式
实验人员在发育过程中发现了三个不同的 S2 簇,它们表达 TGF-β (BMP2, BMP4 和 BMP5) 和非标准 WNT 通路(WNT5A 和 WNT5B) 的关键形成素分子。这些 s2 特异性基因构成了主要的黏膜下成纤维细胞形成素模块的一部分,该模块包含 DLL1、BMP5 和 NRG1(图 6D)。再加上 RL 相互作用,如 DLL1-NOTCH2,突出了 S2 细胞及其在上皮形成中提供的丰富形态形成生态位的重要性。末端回肠(TI)和结肠 S2 细胞有着 885 个差异表达的基因。在 10 PCW 之前这些细胞展现出许多位点特异性差异,代表了在隐窝 / 绒毛形成之前很强的位置一致性,例如,POSTN 和 BMP3 在它们各自的 S2 亚型中很早就出现了(图 6E)。S2 形态形成谱中这种关键的位置差异指明了一种机制,通过这种机制,可以形成不同的上皮形态。
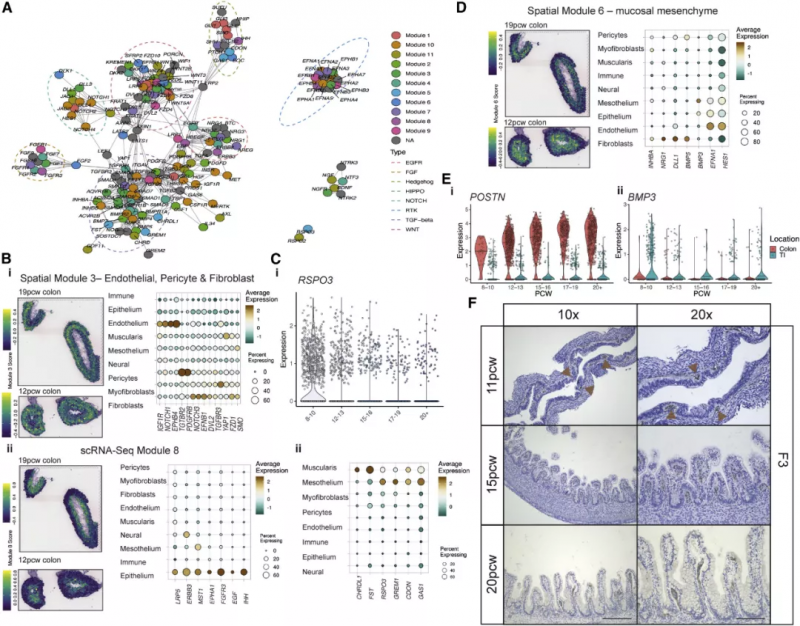
图 6 在特定的细胞类型和空间位置中的肠道形态发生素梯度
7、人类肠道免疫系统的发育
实验中一共捕获到了 6 种共计 2199 个免疫细胞(图 7A,7B)。在 10 PCW 之前,髓系免疫细胞更为丰富,而在第 12PCW 之后会出现幼稚 CD4+ 和 CD8+ T 细胞、自然杀伤细胞(NK)、1 型先天淋巴细胞(ILCs) 和 3 型 ILCs(图 7C)。CCL19, CCL21, 与 CXCL13 是和派伊尔结形成有关的基因,并表达于基质组织细胞中。实验结果表明这些细胞特异性地定位在两个 S4 成纤维细胞簇中,并且随着发育表达增加。通过将黏膜下淋巴滤泡作为独特的结构,研究其空间转录组切片,研究人员在这些滤泡内及周围找到了成人免疫细胞以及 S4 类型细胞(7F),同时也在其中找到了受体 - 配体对,包括 CCR7/CC19。因此认定 S4 细胞是成人结肠中免疫滤泡邻近的成纤维细胞,在胎儿 GALT 发育过程中以时间依赖性的方式出现。考虑到 S4 CXCL13+ 亚型成纤维细胞的缺失会损害派伊尔结的形成,综上认定派伊尔结中隐窝周围成纤维细胞为上皮隐窝生态位支持细胞、淋巴组织形成的协调者和基质 - 免疫交互的介质,实验结果揭示了它们迄今为止未被认识到的高度动态的作用。
图 7 早期肠道免疫定植和免疫基质相互作用
8、绘制先天性肠道疾病的细胞基础图
为揭露严格遵循时间顺序的致病转录缺陷,实验人员整合了健康人类与患病者的数据。通过整合 749 个已知的疾病基因和本次实验的 scRNA-seq 数据,他们将先天性疾病与可能通过高度细胞类型特异性缺陷表现出来并导致肠道、腹侧、会阴、神经节、炎症或肿瘤病理的紊乱的表型联系起来(图 8A,B)。SOX10 和 RET 与巨结肠病相关,在肠神经系统中表达(图 8Cii),包括淋巴相关胶质细胞。考虑到这些细胞在淋巴滤泡形成中发挥作用,实验数据提示了先天性巨结肠疾病与并发症小肠结肠炎的潜在联系——这种并发症是由神经节肠切除后复杂的神经 - 免疫相互作用引起的。由于实验数据足以描述在时间进程上致病基因的变化(图 8D),实验人员还强调了 HMGA2 基因与肠道扭转不良有关。同样,早期抑制性运动神经元特异性 NXN 的致病性变异(图 8Eii) 可导致脐膨出。到该发育进程时,肠道回到了腹部,实验的结果强调了肠神经细胞和肌肉祖细胞在这个过程中可能是至关重要的。
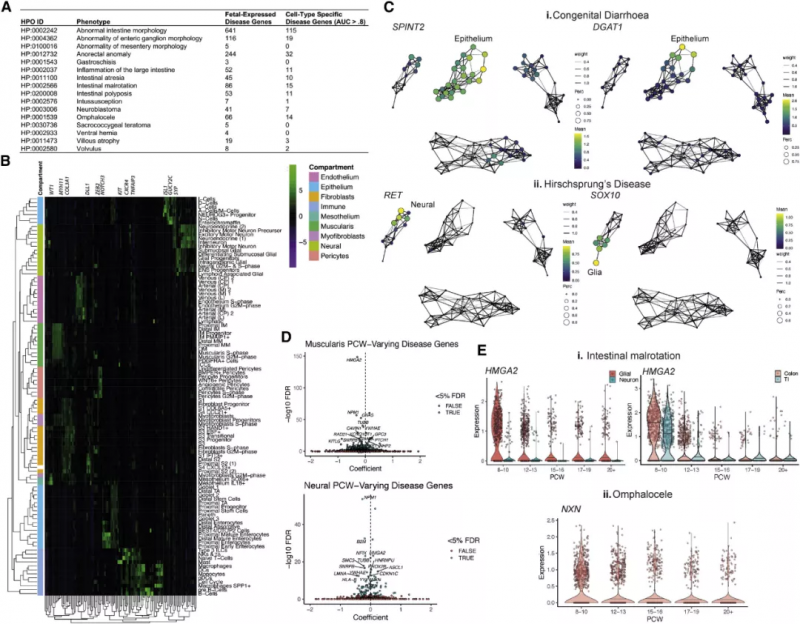
图 8 子宫内基因表达谱在发育性疾病中的应用
总结
参考文献:
[1].Fawkner-Corbett D, Antanaviciute A, Parikh K, Jagielowicz M, Gerós AS, Gupta T, Ashley N, Khamis D, Fowler D, Morrissey E, Cunningham C, Johnson PRV, Koohy H, Simmons A. Spatiotemporal analysis of human intestinal development at single-cell resolution. Cell. 2021 Feb 4;184(3):810-826.e23. doi: 10.1016/j.cell.2020.12.016. Epub 2021 Jan 5. PMID: 33406409; PMCID: PMC7864098.

