人类肠道发育是一个需要多种细胞类型相互协同的高度复杂的过程。早期发育中环境引发的改变与多种免疫介导的病理学有关,包括炎症性肠病(IBD)。过往研究报道了早期胎儿肠上皮细胞动力学与 IBD 之间的联系,提示 IBD 患者的肠上皮中可能重现了类似于胎儿的转录程序。因此,解读肠道发育是预防和治疗此类疾病的关键一步。
位于成人肠隐窝底部的干细胞(LGR5+),分化形成不同的肠道上皮细胞。在 8 -10 个孕周(PCW)时,胎儿肠道上皮细胞就具备了形成自组织的肠上皮类器官的能力,说明此时胎儿肠道已经存在着 LGR5+ 干细胞。然而,人类上皮细胞亚群和其它粘膜细胞类型之间的相互作用,以及肠绒毛的形成和上皮细胞的动力学还未有详细的研究。
近日,来自威康桑格研究所及剑桥大学干细胞研究所等单位的联合研究团队在 Developmental Cell 期刊发表了题为“Single-cell sequencing of developing human gut reveals transcriptional links to childhood crohn’s disease”的文章。该研究对不同发育阶段(胚胎,胎儿和儿童)的人类肠道进行单细胞测序,揭示了与疾病相关的胎儿肠道上皮细胞的组成及其分化状态。

▲文章发表于 Developmental Cell 期刊
研究者首先对 6~10 PCW 的人胚胎进行解剖处理,对 4 至 12 岁的健康儿童的小肠进行粘膜活检,将组织样本分离成单细胞悬浮液,使用 10x Genomics 进行单细胞测序分析。通过对上皮细胞黏附分子(EPCAM)进行磁珠分选来富集肠上皮细胞。该研究共分析了 62,854 个胎儿细胞和 11,302 个儿童回肠末端细胞。结果显示,三个发育阶段(胚胎、胎儿和儿童)均包含七种主要细胞类型,但在细胞组成上却有显著差异,如:在胚胎及胎儿样本中,间充质细胞所占比例和多样性更为丰富;而在儿童样本中则以免疫细胞为主,且在发育中的肠道近端比远端更常观察到分化的细胞状态。此外,单个细胞簇的时空分布表明,胚胎 / 胎儿上皮细胞簇根据肠道区域和发育时间点显著分离,而健康儿童样本中该现象并不明显,这些差异突出显示了在捕获的时间段内肠上皮的主要发育变化(图 1)。
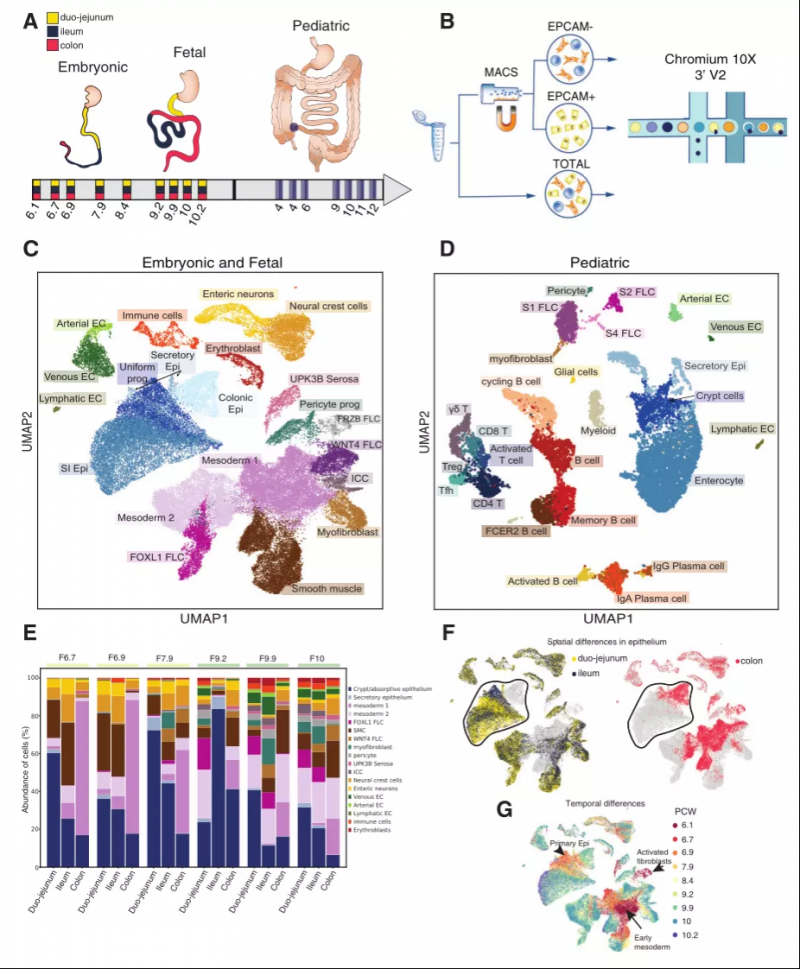
图 1. 胚胎、胎儿和儿童肠道的单细胞图谱分析,来源:Developmental Cell
为进一步阐明肠上皮主要发育变化潜在的机制和途径,研究者探究了肠绒毛形成过程中肠上皮细胞类型的变化。首先基于 EPCAM 的表达对胎儿小肠上皮细胞进行聚类分析,鉴定了 11 个类别及其差异表达基因,包括典型的成体干细胞基因高表达类(包含 LGR5,ASCL2 等)和均一祖细胞类(包含 SHH,PLA2G2A,BEX5 等)。结果显示 10 PCW 时,均一祖细胞数量减少,这与绒毛的出现及 LGR5+ 干细胞、未成熟和成熟的肠细胞、杯状细胞和肠内分泌细胞的出现相一致。接下来研究者使用 BEX5,LGR5 及 MKI67 作为均一祖细胞的标记,来可视化绒毛形成过程中上皮的变化。结果表明,在胚胎阶段,上皮由高度循环的,表达低水平 LGR5 的均一祖细胞组成。此外,研究者利用 scVelo 和 PAGA 轨迹算法研究小肠上皮细胞从胚胎(6-8 PCW)到早期胎儿(9-10 PCW)的细胞分化动力学,结果表明循环上皮经历了从均一上皮到 LGR5+ 干细胞的转录转变。
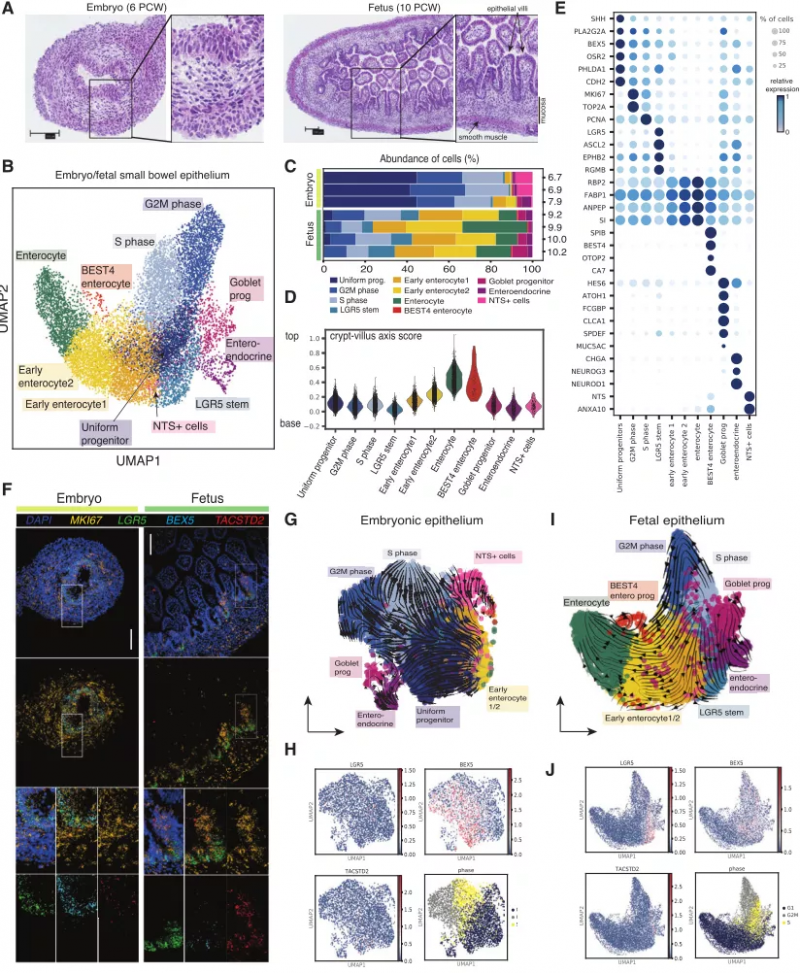
图 2. 人绒毛形成过程中的上皮细胞组成,来源:Developmental Cell
随后,研究者继续探究了与人类绒毛形成有关的机制和信号通路。首先定义了小肠和大肠在不同发育时间点间充质细胞丰度的变化,以鉴定在绒毛形成过程中出现或受限制的潜在细胞类型。在取样时间点,可观察到间充质间室发生重构,且在小肠区域检测到 FOXL1+ 成纤维细胞;在 6 PCW 人胚胎中观察到高表达 PDGFRA 和 FOXL1 / F3 的间充质细胞簇,在 10 PCW 时接近形成的绒毛。之后,利用人类 scRNA-seq 数据,分析确定中胚层细胞、FOXL1+ 成纤维细胞和平滑肌细胞是 hedgehog(HH)信号的主要应答细胞,并进一步确定 FOXL1+ 成纤维细胞与均一祖细胞之间的特异性相互作用是通过 BMP、PDGF、Notch、Wnt 和 FGF 信号通路实现的(图 3)。
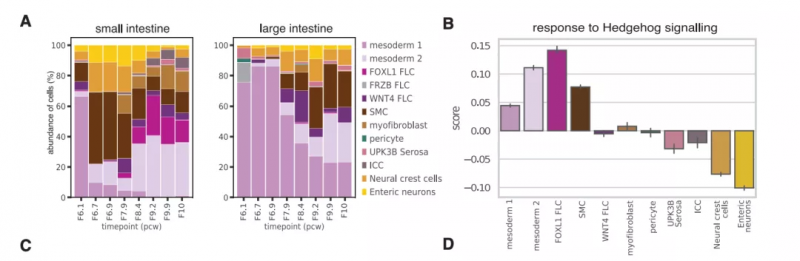
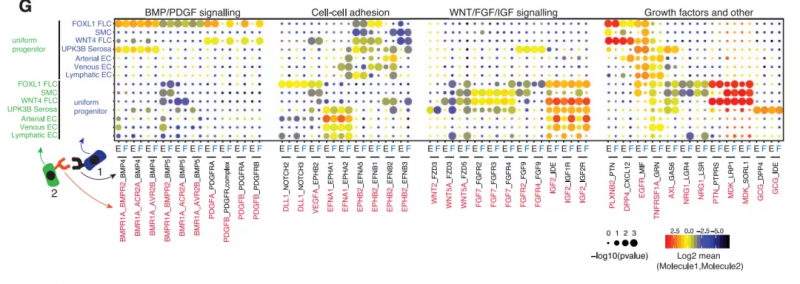
图 3. 从人类胚胎上皮向胎儿上皮转变的细胞间相互作用,来源:Developmental Cell
肠上皮干细胞能够产生各类细胞亚群,这种特性促进了肠类器官培养模型的发展,这些类器官可以由人类胎儿的肠道细胞产生,为研究上皮细胞内在和外在的发育机制提供了机会。研究者利用 scRNA-seq 技术对正在发育的人类肠道类器官进行检测分析,并使用来自原始组织的转录图谱对上皮细胞进行分类。结果显示发育中的肠道中没有检测到 Paneth 细胞和任何表达 Wnt3a 的间充质细胞。之后,在有无 WNT3a 条件培养基的情况下培养肠上皮器官(IEO),结果显示,在 WNT3A 存在下培养的类器官含有更多的分化细胞类型,包括肠上皮细胞和肠内分泌细胞。此外,研究发现在培养物中保存了数月的类器官含有增加比例的分化细胞亚群以及数量增加的 LGR5 + 细胞,这表明当前的肠道培养条件选择了高度增殖的细胞(图 4)。
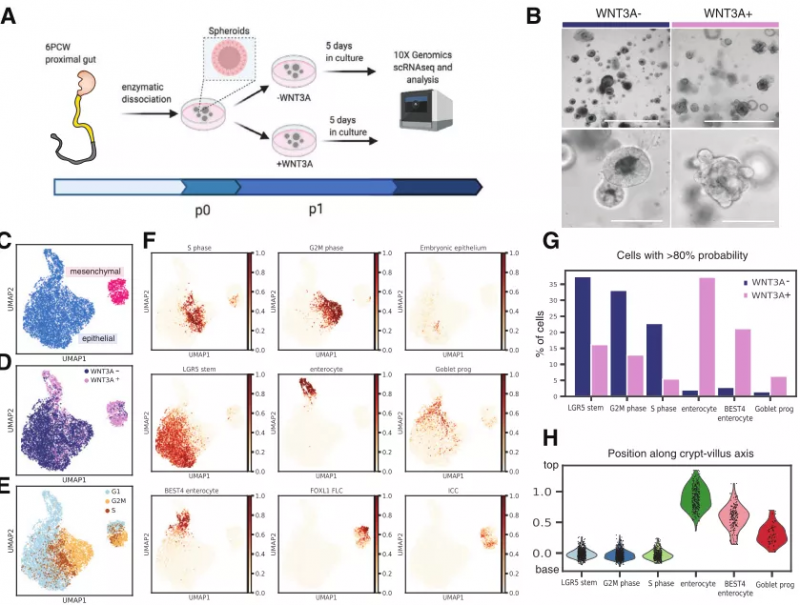
图 4. 胎儿肠道类器官培养,来源:Developmental Cell
研究者对克罗恩病(CD)儿童患者进行 scRNA-seq 末端回肠活检,探究肠上皮成分、功能和细胞动力学变化对 CD 发病机制的影响。结果显示,CD 与对照样本的上皮细胞组成有显著差异,其中转运扩增细胞、杯状细胞和簇状细胞显著增加,且 CD 上皮中完全分化的肠细胞比例显著降低。研究人员同时鉴定出了大量 CD 不同细胞类型之间特异性的相互作用。与健康儿童相比,CD 患者杯状细胞和 S4 成纤维细胞的 TNFSF10-TNFRSF10B 信号的特异性降低,而肠上皮细胞的特异性保持不变。研究者确定了 CD 和发育中的上皮细胞之间共有的转录因子,为 CD 上皮细胞中发育性转录通路的部分重新激活提供了支持性证据。
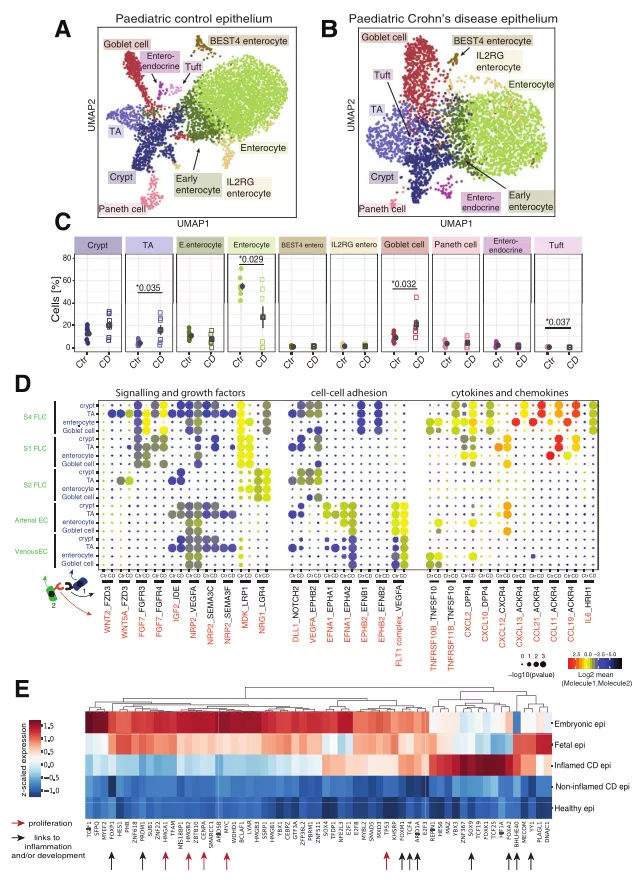
图 5. 来人脑或人脑器官的 scRNA-seq 数据及每个基因模块内基因表达,来源:Developmental Cell
综上所述,该研究提供了人类胚胎、胎儿和儿童健康肠道以及炎症性肠道疾病的单细胞图谱,剖析了肠道生命过程中上皮细胞动态的转录变化。研究同时将数据整理发布在 http://www.gutcellatlas.org/,提供了交互式探索数据的资源。
参考文献:
Elmentaite R, Ross ADB, Roberts K, et al. Single-Cell Sequencing of Developing Human Gut Reveals Transcriptional Links to Childhood Crohn's Disease. Dev Cell. 2020 Dec 1. DOI: 10.1016/j.devcel.2020.11.010.
转载:测序中国(侵删)
更多伯豪生物人工服务:


