【杂志名称】Cell Stem Cell(IF=21.46)
【发表单位】美国波士顿儿童医院,哈佛医学院,波士顿大学,加州大学等
【发表时间】2020-09-04
【主要技术】10XGenomics
概述:KRAS 突变是上皮癌的常见驱动因素。然而,尚不清楚在上皮细胞中致癌性 KRAS 激活后早期发生的分子变化。研究人员比较了四组样本中 KRAS 激活后单细胞分辨率下的转录变化。除了患者样品和基因工程小鼠模型外,研究人员还从原代小鼠和人诱导的多能干细胞衍生的肺上皮细胞开发了类器官系统,从而对早期肺腺癌进行建模。在所有四种情况下,表达致癌性 KRAS 的肺泡上皮祖细胞(AT2)均降低成熟谱系基因的表达。这些发现证明了体外类器官方法可用于揭示致癌性 KRAS 表达的早期结果。该文献提供大量数据集,并描述了能够区别早期肺癌中转录差异的类器官工具,从而有助于寻找 KRAS 驱动的肿瘤靶标。
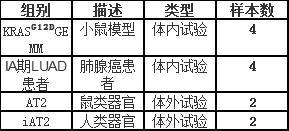
实验样本
主要结果
一、远端肺上皮的 scRNA-Seq 揭示早期肿瘤形成过程中 KRASG12D 激活细胞的特异 Cluster
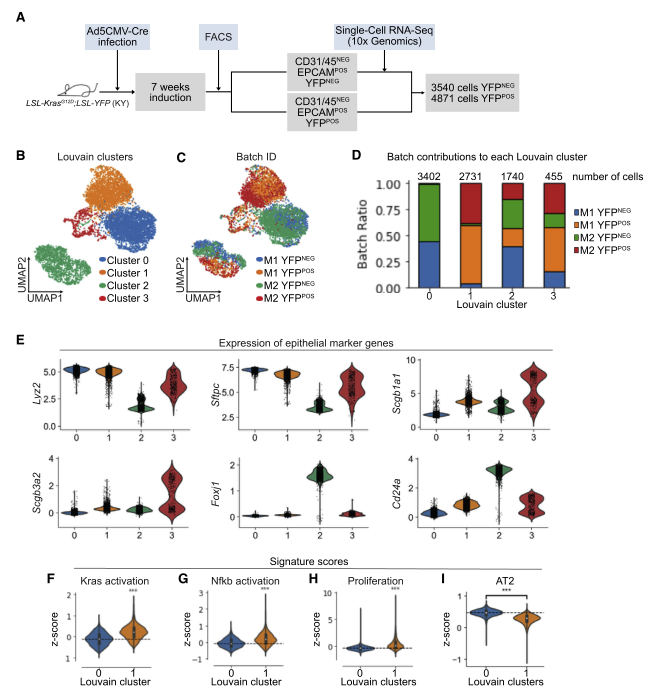
图 1 利用 scRNA-seq 分析体内 LUAD 早期上皮细胞群
用 Ad5-CMV-Cre 感染 KY 小鼠,7 周后,用 FACS 收集重组 [YFP+] 和未重组 [YFP-] 细胞。然后用 10XGenomics scRNA-seq 来检测肺腺癌(LUAD) 早期的基因表达。从图看供分成 4 个亚群,C1 亚群主要由 YFP + 细胞组成,C0 亚群是有 YFP- 细胞组成,而 C2 和 C3 中同时存在 YFP + 和 YFP- 细胞。
AT2 细胞的 marker 基因 Sftpc 和 Lyz2 在 C0 和 C1 中表达高,纤毛细胞的 marker 基因 Foxj1 和 Cd24 在 C2 中表达高,棒状细胞的 marker 基因 Scgb1a1 和 Scgb3a2 在 C3 中表达高。AT2 细胞先前被认为是肺腺癌细胞的起源,并且是一种在 KRASG12D 表达上形成转录上不同簇的肺上皮细胞类型。因此,研究者集中研究了 KRAS 激活对 AT2 细胞的影响。
对 C0 和 C1 两个亚群的基因、转录因子(TF) 和辅助因子(TFC) 进行差异表达(DE) 分析。原癌基因 Myc 和 Id1(一种可促进非小细胞肺癌(NSCLC)细胞增殖和转移的 TF)在 C1 中高表达。转录因子(TF) Nkx2- 1 和 AT2 细胞特征转录因子 Etw5 在 C0 中高表达。此外,与配对的癌旁组织相比,NSCLC 肿瘤组织中发现 TF Foxq1 高表达,肺发育过程中表达的 TF Etv4 以及 Klf4 对诱导细胞的多能性很重要,且在 C1 中高表达。因此,当 KRASG12D 表达时,AT2 细胞下调 TF/TFCs 维持 AT2 细胞特征,而已知促进肿瘤生长、对发育过程重要并诱导多能性的因子表达增加。小鼠 AT2 细胞 Marker 基因表达在 C1 中明显低于 C0。
有报道显示原代人 LUAD 包含表达多种谱系特异性特征的细胞。本研发现 C1 的 AT2 细胞 markers Sftpc,Lyz2 和 Etv5 的表达较低,这与 AT2 细胞特征的丢失一致。值得注意的是,肺泡 1 型(AT1)markers Aqp5 和 Pdpn 以及棒状细胞 markers Scgb1a1 和 Scgb3a2 被上调,表明其他肺上皮细胞类型的转录启动作用。此外,小鼠肺干细胞的 markers Ly6a(SCA1) 和 KrasLSL-G12D/+;p53fl/fl(KP) 肺癌模型中的肿瘤增殖细胞也在一些 C1 细胞中上调。
二、体外类器官可迅速再现体内肿瘤进展
为了更好地了解 KRASG12D 激活后的转录程序,研究者开发了一种体外类器官系统,使他们能够在致癌的 KRAS 诱导后不久快速模拟原代肺 AT2 细胞的变化。通过解剖成年 KY 鼠、KrasLSLG12D/+,p53fl/fl,Rosa26LSL-YFP-KPY 鼠和 Rosa26LSL-YFP(Y) 对照小鼠的肺脏制备类器官,并用 FASC 分离 AT2 细胞。在体外用 Cre 病毒感染细胞,并在 ALI 共培养系统中与基质细胞培养。在 Cre 表达时,几乎所有的有机物都是 YFP+,这表明 Cre 的诱导效率很高。
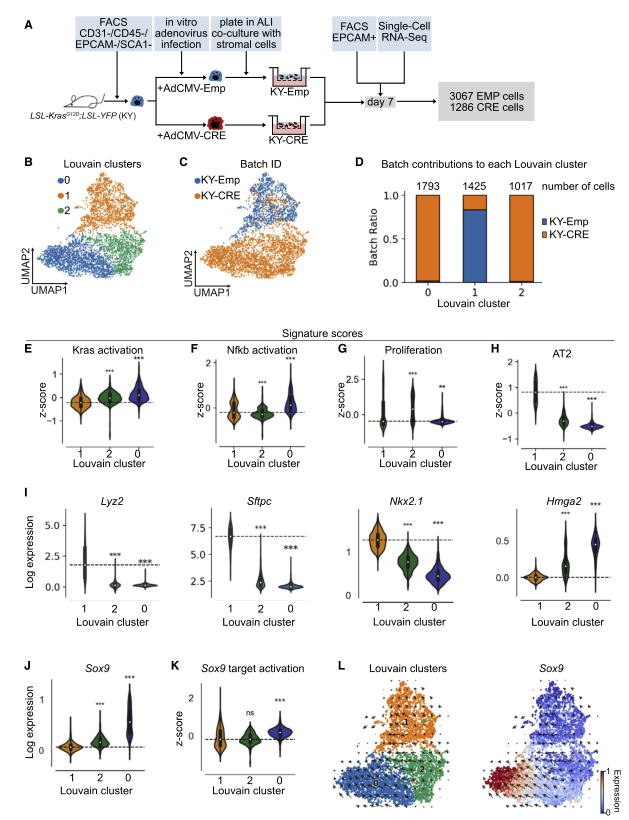
图 2 scRNA-seq 发现表达 KRASG12D 的类器官细胞的转录特征
为了进一步表征 KY-CRE 类器官,研究者对如前所述的来自 KY-CRE 和 KY-Emp 类器官的第 7 天 EPCAM + 细胞进行了 scRNA-seq。数据确定了 3 个亚群:C0org,C 1org 和 C2org。C1org 主要由 KY-Emp 细胞组成,代表对照簇,而 C0org 和 C2org 主要包含 KY-CRE 细胞。相关分析显示,所有三个亚群是不同的,且 C0org 和 C1org 呈负相关。与对照亚群 C1org 相比,C0org 和 C2org 中的 KRAS 激活的基因集上调(E 图)。与 C1org 相比,C2org 中的 NF-kB 激活基因集表达较低(F 图),而 C0org 中的则较高,这表明只有一个 Cre 簇具有上调的 NF-kB 信号传导(F 图)。增殖功能基因集仅在 C2org 中升高,而在 C0org 中没有升高,这表明尽管两个亚群中的 Kras 激活基因基因集表达很高,但 Cre 簇中只有一个具有比对照更高的增殖功能基因集(G 图)。
接下来进行 DE 分析,然后识别 TF / TFC。与 GEMM 数据相似,对照 C1org 的 Etv5 表达升高,提供了 AT2 细胞转录特性丢失的其他证据。与对照相比,在两个 Cre 簇中高表达的 TF 是 Foxq1,而 C2org 具有 Id1 的高表达,GEMM 中也检测到了两个 TF。有趣的是,C0org 在肺发育过程中高表达 TFSox9。在同一亚群中,分别指示 Tgfb 和 p53 信号的 Smad7 和 Trp53 也被上调。
两个 KY-CRE 亚群 C0org 和 C2org 中 AT2 细胞的信号减少,类似于 GEMM 数据。与此一致的是,AT2 细胞标记 Lyz2 和 Sftpc 以及肺部特征的 TF Nkx2- 1 的表达降低(I)。相比之下,两个 KY-CRE 簇中的肺发育基因 Hmga2 和 Sox9 均被上调(I 和 J)。此外,还发现 Sox9 靶基因集在 C0org 中上调,表明 Sox9 在这个亚群中高度表达和活跃(K)。接下来,研究者想验证在 GEMM 中的 YFP+ 亚群中是否也上调了 Sox9。令人惊讶的是,与 YFP-C0 集群相比,YFP+C1 亚群中的 Sox9 和 Sox9 目标激活相关基因显著上调。值得注意的是,与类器官数据相比,GEMM 模型中的变化要细微得多,表达水平也更低。为了确定两个 KY-CRE 簇是否代表癌细胞发展的两个不同阶段,以及是否从一个簇过渡到另一个簇。研究者用 RNA velocity 分析了类器官和 GEMM scRNA-seq 数据集。在类器官数据中,RNA velocity 表明表达 KRASG12D 的 AT2 细胞从 Sox9LOW 过渡到 Sox9HIGH 细胞(图 L)。相比之下,尽管 C1 GEMM 亚群显示出明确的过渡方向,但它并不仅仅针对 Sox9 + 细胞。观察到的差异可能是由于 GEMM 中 Sox9 的表达水平明显降低。
总体而言,研究结果发现 GEMM 与体外诱导的肿瘤类器官系统之间存在许多相似之处。值得注意的是,两个模型中的 AT2 细胞谱系基因均被下调,而发育和祖细胞基因均被上调,这提供了在 LUAD 早期发生分化损失的证据。
三、人 iAT2s 下调 KRASG12D 表达的分化和上调祖细胞的标记
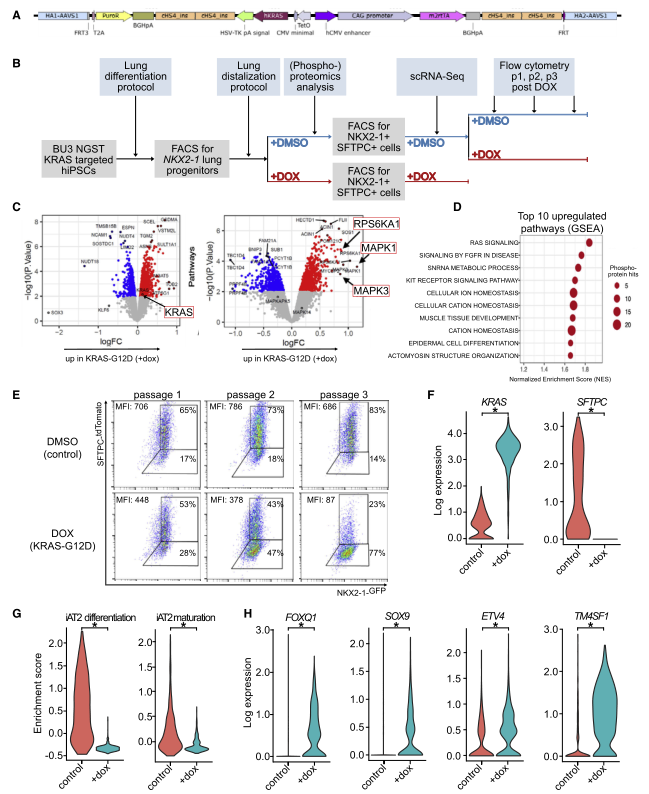
图 3 人 iAT2s 下调 KRASG12d 表达的分化和上调祖细胞的标记
为了验证 KRASG12D 诱导后早期 AT2 分化标志物的丢失是否也可以在人类细胞中观察到,研究者又设计了一个 IPSC 系,允许多西环素(Dox) 调节 iPSC 衍生的 AT2(IAT2) 细胞中 KRASG12D 的激活。利用 IPSC 系 BU3 NKX2-1-GFP;SFTPC-tdTomato(NGST),其中包括分别针对内源性 NKX2- 1 和 SFTPC 基因座的 GFP 和 tdTomato 报告基因,将 KrasG12D 盒与 Dox 诱导启动子一起整合到 AAVS1 基因座中(图 A)。接下来将 iPSCs 分化为 NKX2-1 + 肺上皮祖细胞,通过 FACS 筛选 NKX2-1GFP + 细胞,并使用肺定向分化方案生成远端肺泡球(图 B)。为了更好地了解 SFTPC 的丢失,作者进行了 scRNA-seq(图 B)。使用 10X Chromium 平台,分析了 775 个 DMSO 和 1,322 个经过 dox 处理的细胞的转录组,并进行了 DE 分析。所有细胞的无偏分析显示了 3 个细胞簇,对照 iAT2 细胞归为一个簇。DE 分析显示在两个经 dox 处理的群集中 KRAS 均显着上调,其中之一也显示了增殖标志物(例如 MKI67,TOP2A 和 CDK1)的显着上调(图 F)。相反,在对照簇中多个 AT2 细胞基因被显着上调(例如,LPCAT1,SFTPB,SFTPC,CRLF1,CTSH,SLC34A2,NAPSA 和 PGC)。
与这一观察结果一致,先前发表的 iAT2 细胞分化(SFTPB、SFTPC、SFTPD、CLDN18、LAMP3、SLC34A2、IL8 和 NAPSA) 和成熟(SFTPA1、SFTPA2、PGC、CXCL5 和 SLPI) 基因集和来自 Panglao 数据库的 20 个小鼠与人共享的 AT2 细胞标记在 DOX 处理的 iAT2 细胞(图 G) 中显著下调,作者在 GEMM 和小鼠器官数据中也发现了 TF ETV5。此外,TFs FOXQ1 和 ID1 以及发育和祖基因 SOX9 和 ETV4 均被上调,这也与我们的鼠类数据一致(图 H)。经 dox 处理的 iAT2 细胞中另一个显着上调的转录物是 TM4SF1,报道为 AT2 标记,在体内再生过程中富含 Wnt 反应细胞(图 H)。
人 iAT2 细胞结果表明 KRASG12D 导致 iAT2 分化和成熟标志物的下调以及祖细胞和发育标志物的上调,从而证实了 GEMM 和鼠类器官模型的结果。
四、人早期 LUAD AT2 细胞分化成熟标志物下调
为了评估在 GEMM、小鼠类器官和人 iAT2 细胞模型中观察到的 AT2 细胞特性的丧失是否也发生在肺癌患者中,作者对激活了 KRAS 突变的 LUAD 样本和来自两期 IA LUAD 患者的癌旁组织(距离肿瘤 >2 厘米)进行了 scRNA-seq (图 A)。非监督聚类确定了上皮(EpCAM+)、成纤维细胞(COL1A1+) 和内皮(PECAM1+) 细胞亚群(图 B、E)。上皮细胞进一步分为 AT1(PDPN+)、Club(SCGB1A1+)、纤毛(FOXJ1+) 和两个不同的 AT2 细胞簇,一个由正常肺组织的 AT2 细胞组成,另一个由 LUAD 的 AT2 细胞组成(图 C -E)。来自正常肺的 AT2 细胞以 SFTPB 和 SFTPD 高表达为特征,而来自 1A LUAD 阶段的 AT2 细胞具有 SFTPD 低表达(图 E)。有趣的是,AT2 细胞是在 LUAD 和正常肺组织中形成不同簇的上皮细胞类型,而其他细胞类型却聚集在一起(图 B 和 C),这与我们在 KRASG12DGEMM 中的观察结果一致。接下来,作者检查了来自 Panglao 数据库的小鼠和人类之间共有的 20 种 AT2 细胞标记在 LUAD 患者的 AT2 细胞中的表达。所有 20 种标记物均在正常肺和 LUAD AT2 细胞中高表达,但在其他细胞类型中均未高表达,从而证实 AT2 细胞亚群注释在正常肺和 LUAD 中是合适的(图 F)。但是,与正常肺的 AT2 细胞相比,IA LUAD 阶段的 AT2 细胞表达的这些标志物水平降低,这与作者在 GEMM,鼠类器官和人类 iAT2 细胞模型系统中的发现一致(图 F)。作者认为这是人类早期 LUAD 患者样品中 AT2 细胞特征丢失的首篇文献。
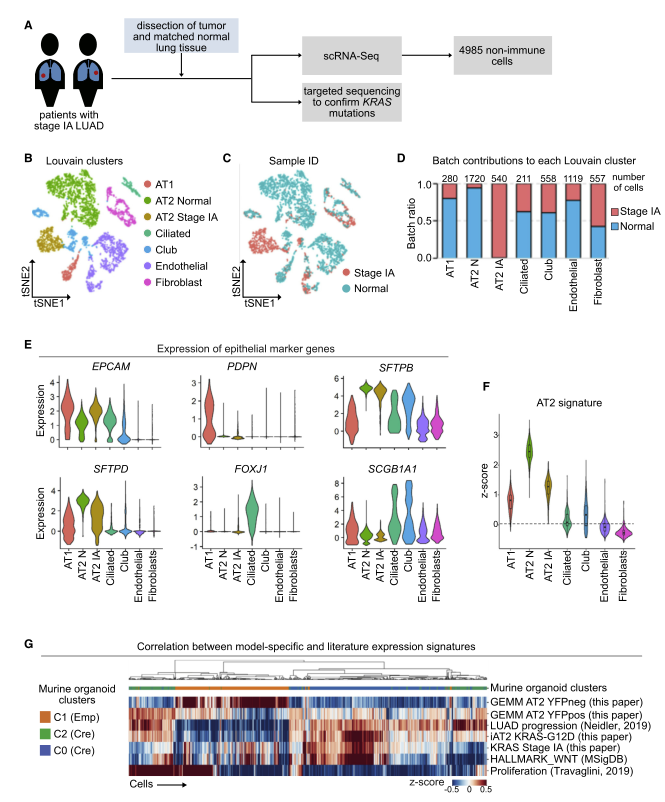
图 4 GEMM,鼠和人类器官模型以及早期 LUAD 患者数据集的比较
为了进一步比较四个 scRNAseq 数据集,作者使用 DE 分析获得的基因集和先前发布的基因集,计算了鼠类 KrasG12D 类器官数据集中每个细胞的 Z -score。如预期的那样,来自 GEMM 的对照 AT2 细胞与对照鼠类器官 AT2 细胞相关。类器官控制 AT2 群 C1 与 GEMM 模型中的 AT2 细胞 YFP+ 群 marker 基因相似(图 G)。此外,具有致癌性 KRAS 的鼠类类器官细胞和具有致癌性 KRAS 的 GEMM 细胞在转录上是相似的。鼠类器官 C0 和 C2 与 AT2 细胞的 YFP + GEMM 相关。人类 KRAS iAT2 和 KRAS 突变患者数据集与鼠类 KRASG12D 细胞 marker 基因相似,其中 iAT2 和患者细胞与 C0 相似。此外,作者从一份使用 KrasG12DGEMM 的报告(Neidler 等人,2019)中发现,研究者的鼠类器官与肺癌进展(“LUAD 进展”)的基因表达特征相关。类器官的数据集还与 HALLMARK_ WNT 基因集,证明了研究者开发的类器官可代替 GEMM,因为已显示 Wnt 途径在肺癌进展中起重要作用。
总结
综上所述,作者的数据表明,成熟的 AT2 转录程序的减少是 KRAS 驱动的 LUAD 启动的重要早期步骤。此外,在 GEMM 和人类 IA LUAD 期患者中证明,在 KRAS 肿瘤发生的早期阶段,只有 AT2 细胞转换到转录上截然不同的状态。此外,体外诱导的类器官系统囊括了早期 LUAD 进展的核心成分,为肺癌生物学研究提供了简便的模型。
更多伯豪生物人工服务:


