1、抗体药 PD1/PDL1
肿瘤浸润性淋巴细胞(tumor infiltrating lymphocytes, TIL):浸润在肿瘤内的淋巴细胞,以 T 细胞为主,也含有其他免疫细胞。由于里边含有能够识别杀伤肿瘤的 T 细胞(肿瘤反应性 T 细胞,tumor reactive T cells)而备受关注。阻断 T 细胞抑制性检查点受体的免疫疗法已经改变了癌症患者的临床护理。然而 T 细胞对检查点阻断的反应是否依赖于预先存在的肿瘤浸润淋巴细胞的再激活或新 T 细胞的募集尚不清楚。2019 年一项发表于 NatureMedicine 上的研究从 11 位诊断为基底细胞癌患者接受 PD- 1 抑制剂治疗前后的组织标本中获取 T 细胞进行 RNA 单细胞测序和 TCR 测序,以研究 PD- 1 抑制剂是否通过肿瘤浸润 T 细胞的“再激活”或是通过招募新的 T 细胞到达肿瘤区域发挥抗肿瘤效应 [1]。
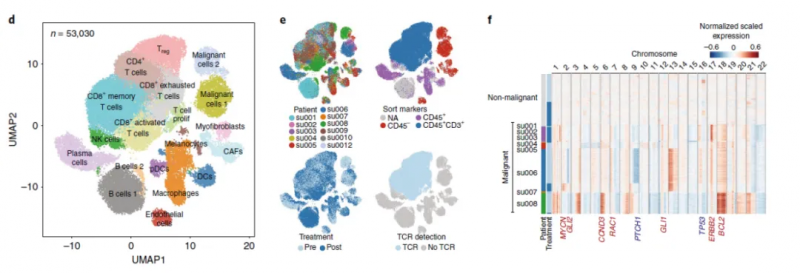
图 11 例患者治疗前后所有肿瘤细胞聚类 [1]
这项研究的重点是免疫细胞,尤其是浸润性免疫细胞,以及治疗前后的变化,以了解克隆性 T 细胞对 PD- 1 抗体治疗的反应。因此研究人员把所有的 33106 个肿瘤浸润性 T 细胞做了个更细致的分类,包括表达 CD4 的调节性 T 细胞(Treg)细胞,滤泡辅助性 T(TFH)细胞,T 辅助细胞 17(TH17)细胞;以及表达 CD8 的 Naive T 细胞,记忆 T 细胞,效应记忆 T 细胞,活化 T 细胞,慢性活化 / 耗竭 T 细胞,中度耗竭 / 活化细胞。进一步分析发现,在 PD- 1 抗体治疗之后,滤泡辅助性 T 细胞,以及活化,耗竭和耗竭 / 活化的 CD8 阳性 T 细胞的频率增加,并且耗竭 T 细胞的克隆水平明显更高。更让研究人员感到意外的是,对于同一个患者而言,治疗后记忆 T 细胞和效应 T 细胞频繁转换为活化状态,但是治疗前的耗竭 T 细胞却没有变成治疗后的非耗竭表型。这表明,即使在 PD- 1 抗体治疗后,已经耗竭的肿瘤浸润 T 细胞也很难再变成活化状态。此外,研究人员还观察到一个有趣的现象,PD- 1 抗体治疗后才出现的耗竭性 T 细胞表现出了新的 TCR 特异性。为了分析外周血中是否存在新发现的肿瘤浸润性 T 细胞,研究人员给患者的血液样品做了 TCR 测序,发现 35.5% 新肿瘤浸润性 T 细胞可以在 PD- 1 抗体治疗后的外周血中找到,而在治疗前的外周血中只能找到 11.8% 的新肿瘤浸润性 T 细胞,不过治疗前的肿瘤里面却没有新肿瘤浸润性 T 细胞。总的来说,与“冷”肿瘤相比,“热”肿瘤之所以响应 PD- 1 抗体的治疗,可能是由于“热”肿瘤自身的特性,让它能够不断吸引新 T 细胞进入,而不是重新激活已有的肿瘤浸润性 T 细胞。这项研究让我们对免疫检查点抑制剂的作用机制有了新的认知,这对临床治疗和疗效的检测都有一定的价值和意义。
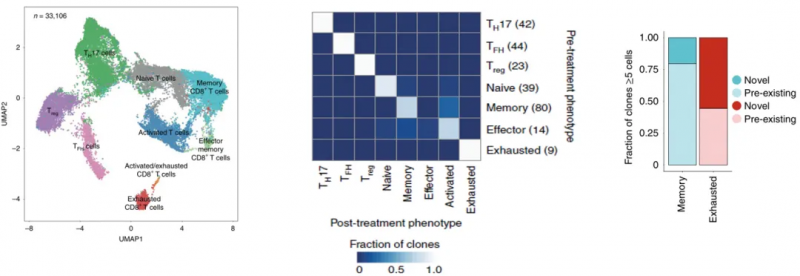
图 肿瘤浸润性 T 细胞(左)、耗竭的肿瘤浸润 T 细胞很难再变成活化状态(中)以及治疗后衰竭 CD8 + T 细胞的克隆库被新型克隆所取代(右)[1]
2、 细胞治疗
目前,以 CD19 为靶点的 CAR- T 细胞治疗已被证明对复发性、难治性 B 细胞恶性肿瘤如 B 细胞非霍奇金淋巴瘤(NHL)、急性淋巴细胞白血病(ALL)和慢性淋巴细胞白血病(CLL)有显著的治疗作用 [2]。虽然抗 CD19 CAR- T 细胞治疗的早期结果令人欣喜,但是只有不到一半的患者出现了长期的缓解,这意味着大多数患者在接受治疗后要么没有反应要么出现了复发。CAR- T 细胞治疗在不同患者中出现的这些差异的原因到底是什么?2020 年 10 月 5 日在线发表在《Nature Medicine》杂志上的文章探讨了这一问题。对 24 例大 B 细胞淋巴瘤(LBCL) 患者输注自体 CAR- T 细胞后,研究人员对 137,326 个残留的细胞进行了全转录组 scRNA-seq [3]。
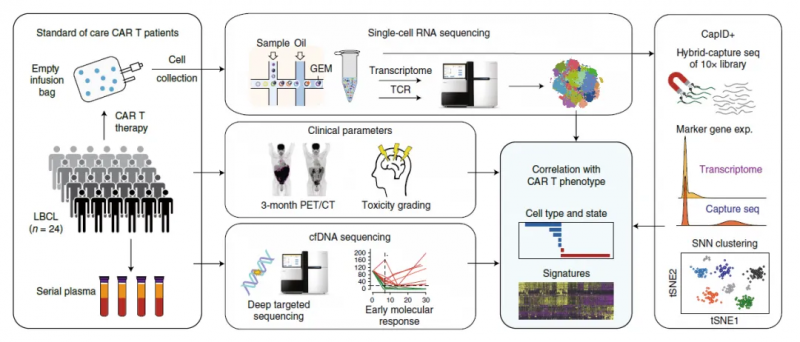
图 工作流程图 [3]
比较全部恢复(CR) 患者和疾病进行 / 部分恢复(PR/PD) 患者输注产物的细胞类型和功能状态,研究人员发现 PR/PD 患者的输注产物中衰竭的 CD8 和 CD4 T 细胞显著富集,而 CR 患者的输注产物中记忆 CD8 T 细胞显著富集。CR 患者和 PR/PD 患者 CD8 T 细胞的差异表达基因(DEG)鉴定出 4 类细胞群,这些差异表达基因大多与 CD8 T 细胞的激活和衰竭有关,虽然每个细胞群都包含来自所有患者的细胞,但是来自 CR 患者的细胞的相对比例在各个细胞群之间存在显著差异。CD4 T 细胞的 DEG 分析和聚类也表现出类似结果,不同的是增殖相关基因和周期细胞在 CR 患者的高频细胞聚类中表达较高。由此强调了与临床疗效相关的 CAR- T 细胞输注产物细胞的重要转录特征。研究表明输注的 CAR T 细胞产物的细胞和分子多样性是导致经抗 CD19-CAR- T 细胞治疗的 LBCL 患者疗效和毒性差异的主要因素,与输注产物相关的可量化表型可通过在其产生过程中富集所需的、或消除不期望的细胞群体或功能状态而发挥作用。对离散细胞群导致反应不良或高毒性的机制的了解,可能有助于发现治疗干预的途径,从而提高疗效,降低 CAR- T 细胞输注后的毒性。
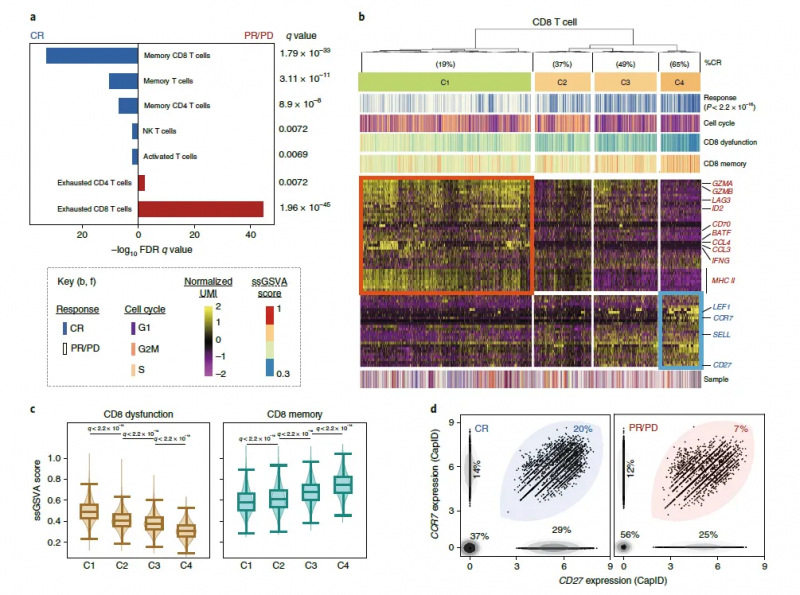
图 CD8T 细胞细分及功能富集 [3]
参考文献:
[1]. Li X, Wang M, Xiang R. Clonal replacement of novel T cells: a new phenomenon in the tumor microenvironment following PD-1 blockade[J]. Signal Transduction and Targeted Therapy, 2019, 4:43.
[2]. Neelapu Sattva S, Locke Frederick L, Bartlett Nancy L, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma[J]. New England Journal of Medicine, 2017, 377:2531-2544.
[3]. Deng Qing, Han Guangchun, Puebla-Osorio Nahum, et al. Characteristics of anti-CD19 CAR T cell infusion products associated with efficacy and toxicity in patients with large B cell lymphomas[J]. Nature Medicine, 2020, 26:1878-1887.
更多伯豪生物人工服务:


